Jawaban soal a.
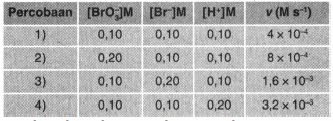
Orde reaksi adalah tingkat reaksi suatu zat dalam suatu persamaan reaksi. Orde reaksi tidak sama dengan koefisien. Salah satu cara menentukan orde reaksi adalah dengan membandingkan dua persamaan laju dari percobaan yang berbeda. Untuk mencari orde reaksi pada soal tersebut maka langkahnya adalah.
Langkah 1. Tentukan orde reaksi [BrO3−]
Orde reaksi [BrO3−] ditentukan dengan membandingkan persamaan laju dua percobaan dalam tabel dengan konsentrasi [Br−] dan [H+] yang sama. Pada soal ini adalah percobaan 1 dan 2. Kita misalkan orde reaksi [BrO3−] adalah x dan orde reaksi [Br−] adalah y serta orde reaksi [H+] adalah z. Mencari orde reaksi [BrO3−]:
Persamaan laju reaksi: v=k [BrO3−]x[Br−]y[H+]z
vr2=k [BrO3−]x[Br−]y[H+]zvr1=k [BrO3−]x[Br−]y[H+]z8×10−4=k [0,2]x[0,1]y[0,1]z4×10−4=k [0,1]x[0,1]y[0,1]z21=[0,2]x[0,1]xx=1
Langkah 2. Menentukan orde reaksi [Br−]
Orde reaksi [Br−] ditentukan dengan membandingkan persamaan laju dua percobaan dalam tabel dengan konsentrasi [BrO3−] dan [H+] yang sama. Pada soal ini adalah percobaan 1 dan 3.
vr3=k [BrO3−]x[Br−]y[H+]zvr1=k [BrO3−]x[Br−]y[H+]z1,6×10−3=k [0,1]x[0,2]y[0,1]z4×10−4=k [0,1]x[0,1]y[0,1]z41=[0,2]y[0,1]yy=2
Langkah 3. Menentukan orde reaksi [H+]
Orde reaksi [H+] ditentukan dengan membandingkan persamaan laju dua percobaan dalam tabel dengan konsentrasi [BrO3−] dan [Br−] yang sama. Pada soal ini adalah percobaan 1 dan 4.
vr4=k [BrO3−]x[Br−]y[H+]zvr1=k [BrO3−]x[Br−]y[H+]z3,2×10−3=k [0,1]x[0,1]y[0,2]z4×10−4=k [0,1]x[0,1]y[0,1]z81=[0,2]z[0,1]zz=3
Berdasarkan perhitungan tersebut maka orde reaksi terhadap [BrO3−] adalah 1, orde reaksi terhadap [Br−] adalah 2 dan orde reaksi terhadap [H+] adalah 3.
Jawaban soal b.
Persamaan laju reaksi setelah ditemukan orde reaksi adalah dengan mengganti x, y, dan z pada formula persamaan hukum laju, Jadi persamaan laju reaksinya adalah:
v=k [BrO3−]1[Br−]2[H+]3