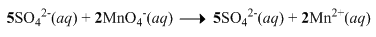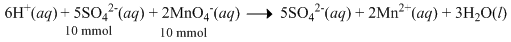Iklan
Pertanyaan
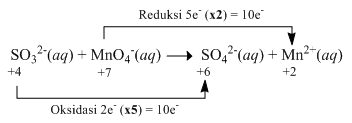
Oksidasi ion sulfit ( SO 3 2 − ) dapat dilakukan denganmenggunakan ion permanganat ( MnO 4 − ) menurutreaksi berikut: 6 H + ( a q ) + 5 SO 3 2 − ( a q ) + 2 MnO 4 − ( a q ) → 5 SO 4 2 − ( a q ) + 2 Mn 2 + ( a q ) + 3 H 2 O ( l ) Dalam suatu reaksi digunakan 100 mL larutan H 2 SO 3 0,10 M dan 100 mL larutan KMnO 4 yang didapat daripengenceran 5 mL larutan KMnO 4 2,0 M. Jumlah mol elektron yang terlibat dalam reaksi tersebut adalah ....
Oksidasi ion sulfit () dapat dilakukan dengan menggunakan ion permanganat () menurut reaksi berikut:
Dalam suatu reaksi digunakan 100 mL larutan 0,10 M dan 100 mL larutan yang didapat dari pengenceran 5 mL larutan 2,0 M.
Jumlah mol elektron yang terlibat dalam reaksi tersebut adalah ....
0,02 mol
0,04 mol
0,08 mol
0,10 mol
0,12 mol
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
5
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia