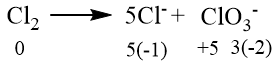Iklan
Pertanyaan
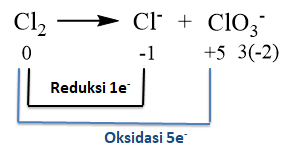
Dalam suasana basa, Cl 2 mengalami reaksi disproporsionasi menghasilkan ion Cl − dan ClO 3 − . Jumlah mol ion ClO 3 − yang dihasilkan dari 1 mol Cl 2 adalah ...
Dalam suasana basa, mengalami reaksi disproporsionasi menghasilkan ion dan . Jumlah mol ion yang dihasilkan dari 1 mol adalah ...
1
2
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
3
5.0 (7 rating)
RN
Risa Nababan
Mudah dimengerti
NR
Nadia Raoda
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia