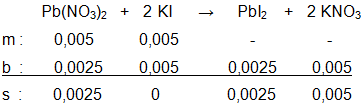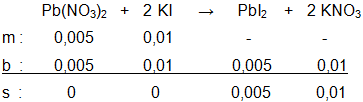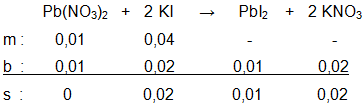Iklan
Pertanyaan
Larutan timbal(II) nitrat direaksikan dengan larutan KI sesuai reaksi: Pb ( NO 3 ) 2 ( a q ) + 2 KI ( a q ) → PbI 2 ( s ) + 2 KNO 3 ( a q ) Tentukan massa PbI 2 ( A r Pb = 207 dan I = 127) yang terbentuk, jika direaksikan: a. 50 mL larutan Pb ( NO 3 ) 2 0,1 M dan 50 mL larutan KI 0,1 M b. 50 mL larutan 0,1 M dan 100 mL larutan KI 0,1 M c. 50 mL larutan 0,2 M dan 400 mL larutan KI 0,1 M
Larutan timbal(II) nitrat direaksikan dengan larutan KI sesuai reaksi:
Tentukan massa ( Pb = 207 dan I = 127) yang terbentuk, jika direaksikan:
a. 50 mL larutan 0,1 M dan 50 mL larutan KI 0,1 M
b. 50 mL larutan 0,1 M dan 100 mL larutan KI 0,1 M
c. 50 mL larutan 0,2 M dan 400 mL larutan KI 0,1 M
Iklan
I. Solichah
Master Teacher
16
4.6 (6 rating)
Abel Darwin
Pembahasan lengkap banget Makasih ❤️
Ahnaf Hafizh
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Makasih ❤️ Bantu banget
Aulia Amalia
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia