Iklan
Pertanyaan
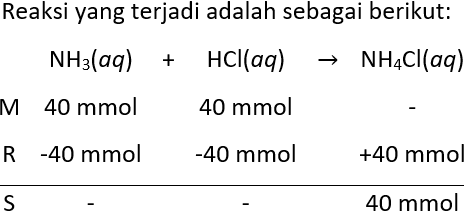
Larutan-larutan dicampurkan sebagai berikut. 100 mL NH 3 0,4 M ( K b NH 3 = 2 × 1 0 − 5 ) + 400 mLHCI 0,1 M Hitung pH larutan sebelum dan sesudah pencampuran.
Larutan-larutan dicampurkan sebagai berikut.
100 mL 0,4 M + 400 mL HCI 0,1 M
Hitung pH larutan sebelum dan sesudah pencampuran.
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
6
5.0 (2 rating)
AA
Abdullah Averouse Ibnu Sina
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
K
Kanaya
Mudah dimengerti Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia