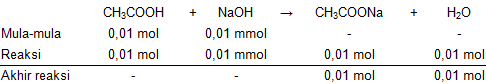Iklan
Pertanyaan
Larutan asam asetat 0,1 M sebanyak 100 ml mempunyai pH = 3. Jika 0,4 gram NaOH dicampurkan ke dalam larutan ini, tentukan pH larutan yang terbentuk ! ( M r NaOH = 40)
Larutan asam asetat 0,1 M sebanyak 100 ml mempunyai pH = 3. Jika 0,4 gram NaOH dicampurkan ke dalam larutan ini, tentukan pH larutan yang terbentuk ! ( NaOH = 40)
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
15
4.8 (27 rating)
hs
herida syaluna purnamasari
Makasih ❤️
HA
Hanivafauzia Azzahra
Pembahasan lengkap banget Makasih ❤️
CP
Celine Paramita Chandra
Pembahasan lengkap banget Ini yang aku cari! Bantu banget Makasih ❤️
A
Ayya
Jawaban tidak sesuai
Iklan
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia