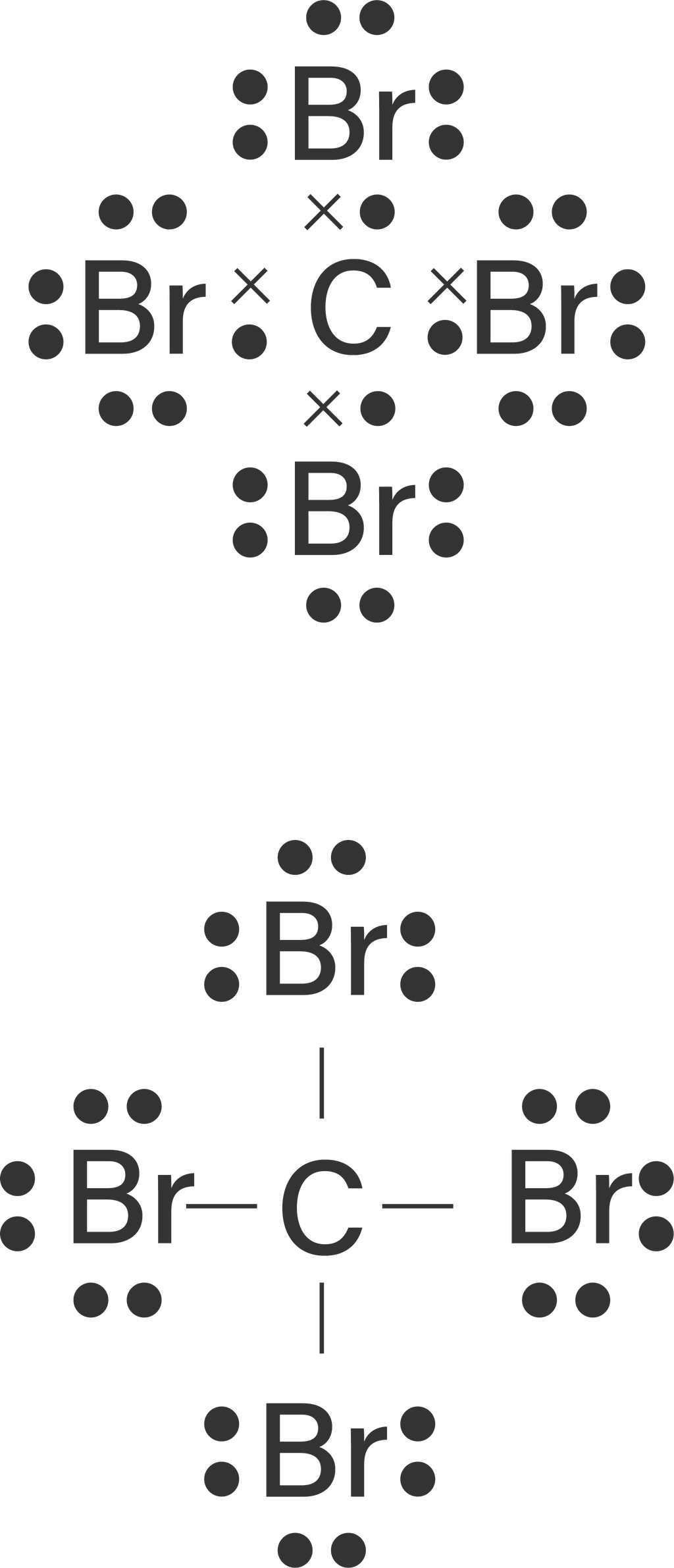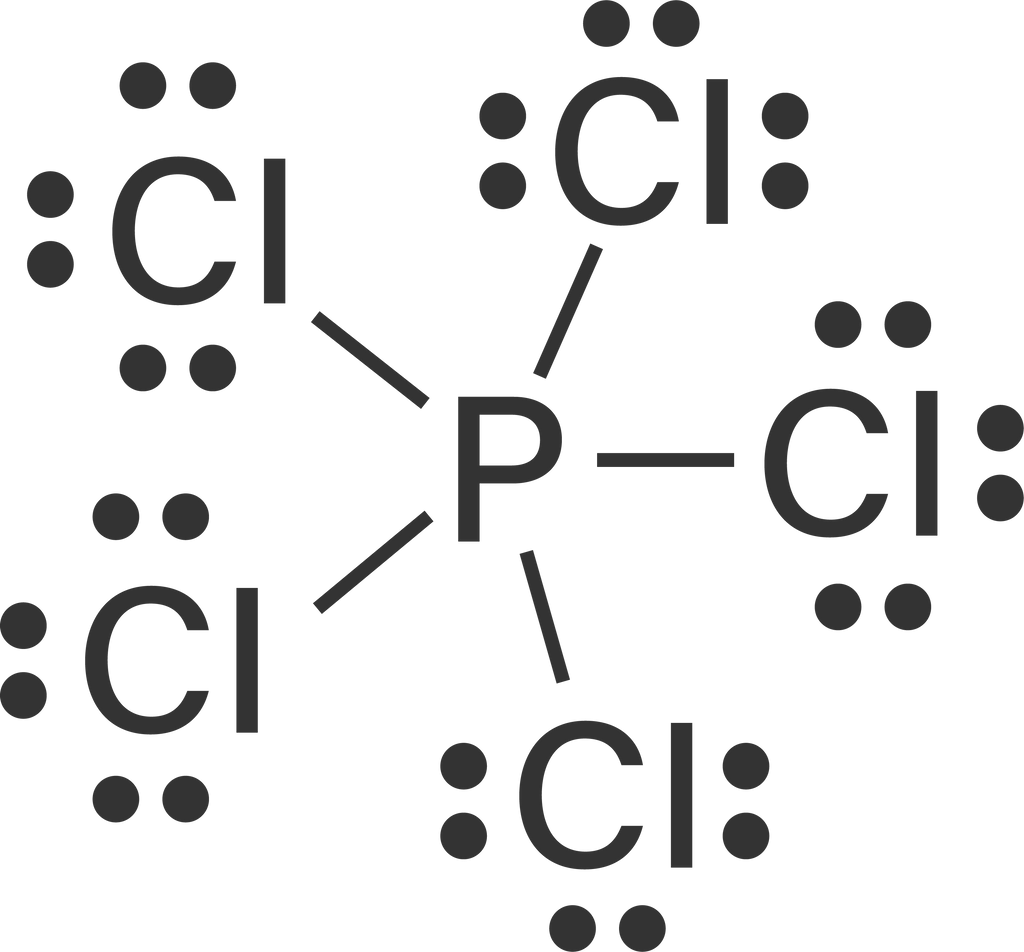Iklan
Pertanyaan
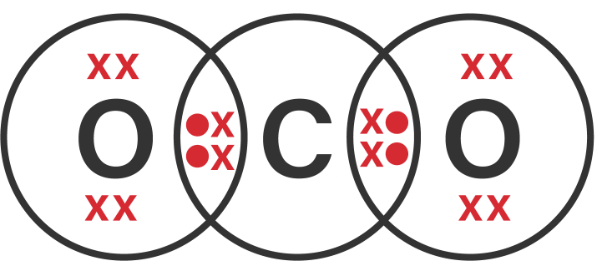
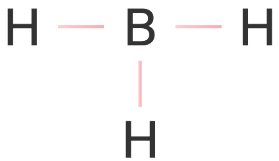
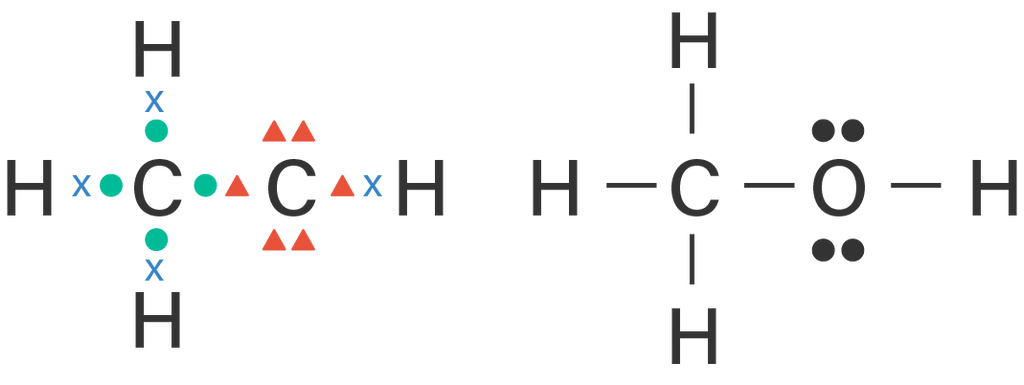
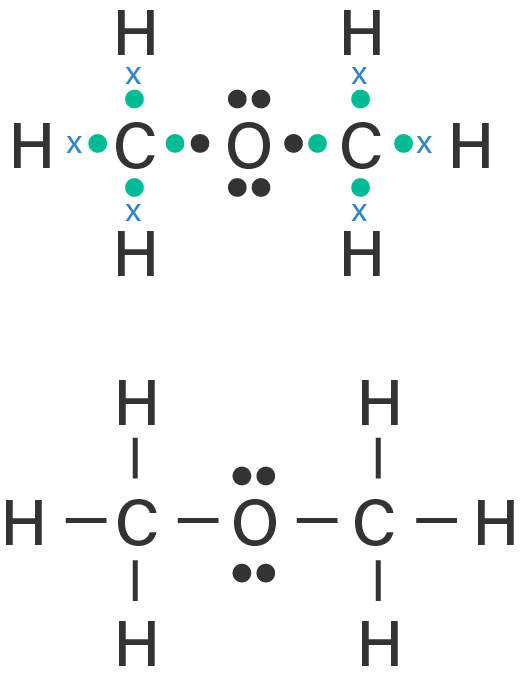
Kelompokkanlah senyawa-senyawa berikut ini berdasarkan kepolarannya. a . CBr 4 b . F 2 c . PCl 5 d . H 2 O e . CO 2 f . BH 3 g . CH 3 OH h . CH 3 − O − CH 3 i . H − O − O − H
Kelompokkanlah senyawa-senyawa berikut ini berdasarkan kepolarannya.
Iklan
AK
A. Kusbardini
Master Teacher
Mahasiswa/Alumni UIN Syarif Hidayatullah Jakarta
Jawaban terverifikasi
3
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia