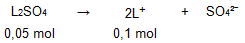Iklan
Pertanyaan
Ke dalam larutan basa lemah LOH ditambahkan padatan garam L 2 SO 4 , sehingga konsentrasi LOH menjadi 0,1 M dan konsentrasi L 2 SO 4 sebesar 0,05 M . Bila K b LOH = 1 0 − 5 maka p H campuran adalah ...
Ke dalam larutan basa lemah ditambahkan padatan garam , sehingga konsentrasi menjadi 0,1 M dan konsentrasi sebesar 0,05 M. Bila maka pH campuran adalah ...
11
9 + log 2
9
5
5 - log 2
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
10
4.8 (54 rating)
ANINDIKA RISQUITA SHIRADEVA
Pembahasan lengkap banget
Mira Marlianti
Pembahasan lengkap banget
Hafiz Syaputra
Pembahasan lengkap banget
Rosa Amelia
Makasih ❤️ Ini yang aku cari! Bantu banget Pembahasan lengkap banget Mudah dimengerti
Cindy Oktavia Putri Ramadhan
Pembahasan lengkap banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia