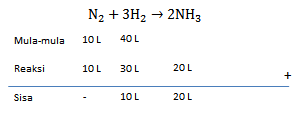Iklan
Iklan
Pertanyaan
Jika 10 L gas nitrogeb direaksikan dengan 40 L gas hidrogen menghasilkan gas amonia, menurut reaksi berikut: N 2 ( g ) + 3 H 2 ( g ) → 2 NH 3 ( g ) Tentukan: a. Pereaksi hambatan b. Volume reaksi sisa c. volume hasil reaksi
Jika 10 L gas nitrogeb direaksikan dengan 40 L gas hidrogen menghasilkan gas amonia, menurut reaksi berikut:
Tentukan:
a. Pereaksi hambatan
b. Volume reaksi sisa
c. volume hasil reaksi
Iklan
FK
F. Krisna
Master Teacher
Mahasiswa/Alumni Institut Pertanian Bogor
Jawaban terverifikasi
1
2.0 (1 rating)
i
intann
Jawaban tidak sesuai
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia