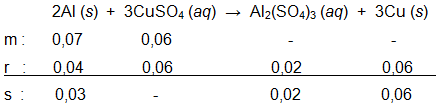Iklan
Pertanyaan
Sebanyak 2 g aluminium direaksikan dengan 100 mL larutan CuSO 4 0,6 M sesuai reaksi berikut. Al ( s ) + CuSO 4 ( a q ) → Al 2 ( SO 4 ) 3 ( a q ) + Cu ( s ) (belum setara) Pernyataan yang benar mengenai reaksi tersebut adalah .... ( A r : Al = 27 g mol − 1 , Cu = 63 , 5 g mol − 1 , S = 32 g mol − 1 , dan O = 16 g mol − 1 )
Sebanyak 2 g aluminium direaksikan dengan 100 mL larutan 0,6 M sesuai reaksi berikut.
(belum setara)
Pernyataan yang benar mengenai reaksi tersebut adalah ....
Dihasilkan 2 mmol
di akhir reaksi
Pada akhir reaksi, konsentrasi
0,2 M
Jumlah tembaga yang terbentuk sebanyak
atom
Setelah reaksi berlangsung terdapat 3,175 g tembaga
Logam aluminium bertindak sebagai pereaksi pembatas
Iklan
SU
S. Utari
Master Teacher
Mahasiswa/Alumni Universitas Negeri Medan
Jawaban terverifikasi
3
4.7 (7 rating)
PG
Padi Gaming
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia