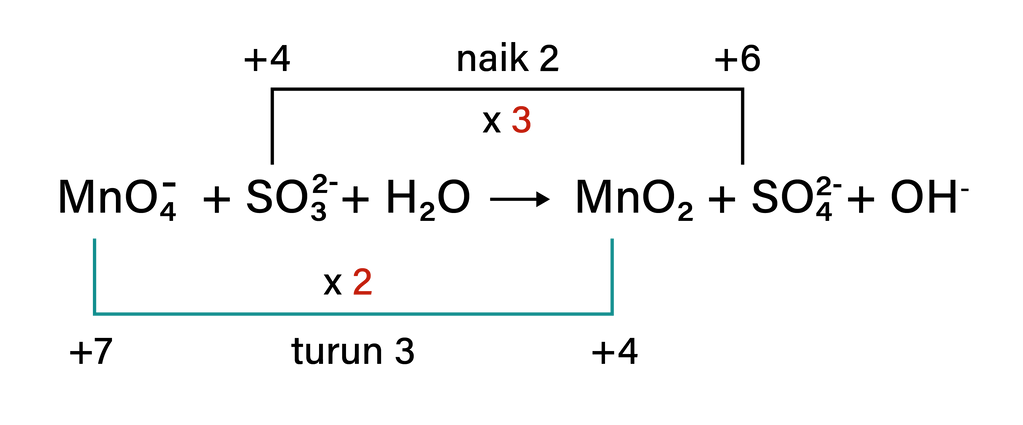Cara penyetaraan persamaan reaksi redoks dapat dilakukan dengan dua cara, yaitu cara setengah reaksi dan cara perubahan bilangan oksidasi. Cara penyetaraan persamaan reaksi redoks dengan cara setengah reaksi yaitu dengan melihat elektron yang diterima atau dilepaskan. Penyetaraan dilakukan dengan menyamakan jumlah elektronnya. Cara ini diutamakan untuk reaksi dengan suasana reaksi telah diketahui. Cara penyetaraan persamaan reaksi dengan cara perubahan bilangan oksidasi yaitu dengan cara melihat perubahan bilangan oksidasinya. Penyetaraan dilakukan dengan menyamakan perubahan bilangan oksidasi.
Langkah-langkah penyetaraan persamaan reaksi di atas adalah sebagai berikut.
- Menentukan perubahan bilangan oksidasi dan menyamakan perubahan bilangan oksidasinya.

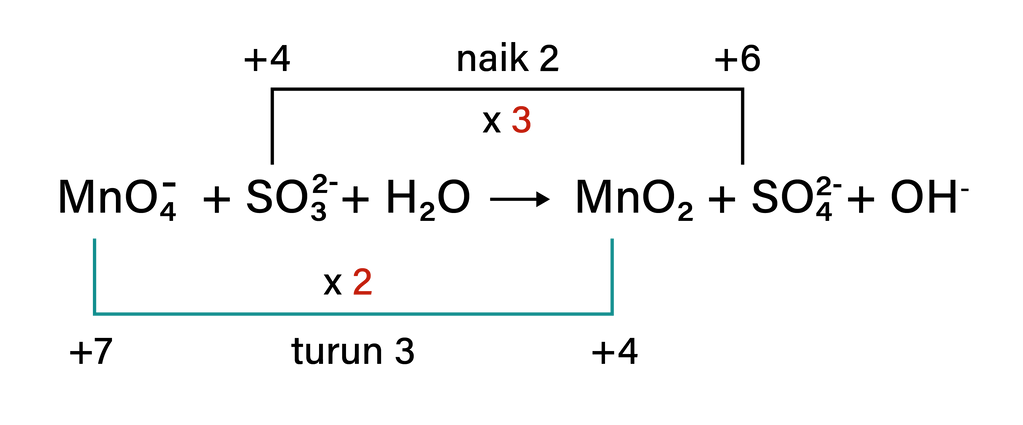
Pada persamaan reaksi di atas, atom S mengalami kenaikan biloks sebanyak 2, sedangkan atom Mn mengalami penurunan biloks sebanyak 3. Untuk menyamakan perubahan biloks keduanya, maka pada reaksi oksidasi reaksinya dikalikan 3, sedangkan pada reaksi reduksi reaksinya dikalikan 2 agar jumlah perubahan biloksnya sama dengan 6.
- Memberikan koefisien reaksi pada reaksi oksidasi dan reduksi sesuai angka pengalinya.

Untuk menyamakan perubahan biloks pada reaksi reduksi dan oksidasi, maka pada reaksi oksidasi koefisien reaksinya dikalikan 3, sedangkan pada reaksi reduksi koefisien reaksinya dikalikan 2. Dengan demikian, maka persamaan reaksinya menjadi seperti berikut.

- Menyamakan jumlah muatan pada kedua ruas persamaan reaksi.

Untuk menyamakan jumlah muatan di ruas kiri kanan, dilakukan dengan menambahkan koefisien di depan ion  . Jumlah muatan pada ruas kiri adalah -8, sedangkan muatan di ruas kanan adalah -6, maka ditambahkan koefisien 2 di depan ion
. Jumlah muatan pada ruas kiri adalah -8, sedangkan muatan di ruas kanan adalah -6, maka ditambahkan koefisien 2 di depan ion  . Persamaan reaksi yang telah disetarakan muatannya adalah sebagai berikut.
. Persamaan reaksi yang telah disetarakan muatannya adalah sebagai berikut.

- Menyamakan jumlah atom oksigen di kedua ruas.

Jumlah atom O di ruas kiri = 18, dan jumlah atom O di ruas kanan = 18. Jadi jumlah atom O di kedua ruas telah sama, sehingga tidak ada yang perlu ditambahkan lagi.Persamaan reaksi setaranya adalah sebagai berikut.

Dengan demikian, maka setelah persamaan reaksi disetarakan, nilai a = 2, b = 3, c = 1, d = 2, e = 3, dan f = 2.
Jadi, nilai koefisien a, b, c, d, e, dan f berturut-turut adalah 2, 3, 1, 2, 3, dan 2.