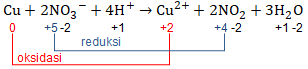REDOKS : Reaksi Reduksi dan Reaksi Oksidasi
- Reaksi Reduksi : Penurunan bilangan oksidasi
- Reaksi Oksidasi: Kenaikan bilangan oksidasi
Ketika terdapat beberapa persamaan reaksi, untuk mengidentifikasi reaksi redoks bisa dilihat dari adanya unsur bebas yang berubah menjadi senyawa/ion pada persamaan kimia berikut. Pada persamaan kimia di atas, yang memiliki unsur bebas yaitu reaksi 1, 2 dan 3
ATURAN BILANGAN OKSIDASI:
- Bilangan oksidasi unsur bebas = 0
- Jumlah bilangan oksidasi dalam suatu ion sama dengan muatan ion tersebut
- Jumlah bilangan oksidasi seluruh atom-atom dalam senyawa netral = 0
- Bilangan oksidasi oksigen = -2, kecuali dalam senyawa peroksida
Berdasarkan aturan bilangan oksidasi di atas, maka bilangan oksidasi masing-masing unsur pada persamaan kimia, dapat dituliskan seperti di bawah ini.
REAKSI 1:
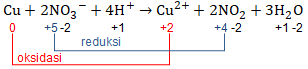
Bilangan oksidasi  mengalami kenaikan dari 0 menjadi +2, sedangkan bilangan oksidasi
mengalami kenaikan dari 0 menjadi +2, sedangkan bilangan oksidasi  mengalami penurunan dari +5 menjadi +4. Karena reaksi ini mengalami kenaikan dan penurunan bilangan oksidasi maka reaksi ini termasuk reaksi redoks.
mengalami penurunan dari +5 menjadi +4. Karena reaksi ini mengalami kenaikan dan penurunan bilangan oksidasi maka reaksi ini termasuk reaksi redoks.
REAKSI 2:

Bilangan oksidasi As mengalami kenaikan dari +3 menjadi +5, sedangkan bilangan oksidasi Br mengalami penurunan dari 0 menjadi -1. Karena reaksi ini mengalami kenaikan dan penurunan bilangan oksidasi maka reaksi ini termasuk reaksi redoks.
REAKSI 3:
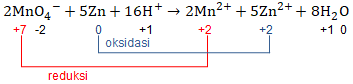
Bilangan oksidasi Mn mengalami penurunan dari +7 menjadi +2, sedangkan bilangan oksidasi Zn mengalami kenaikan dari 0 menjadi +2. Karena reaksi ini mengalami kenaikan dan penurunan bilangan oksidasi maka reaksi ini termasuk reaksi redoks.
Jadi, yang merupakan reaksi redoks adalah reaksi no 1, 2, dan 3.