Iklan
Pertanyaan
Diagram sel volta berikut digunakan untuk menjawab soal nomor 42 dan 43. Pernyataan yang tidak benar mengenai sel Volta tersebut adalah ...
Diagram sel volta berikut digunakan untuk menjawab soal nomor 42 dan 43.
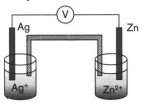
Pernyataan yang tidak benar mengenai sel Volta tersebut adalah ...
Logam zink berfungsi sebagai anode.
Elektron mengalir dari
ke
.
Potensial elektrode yang dihasilkan adalah + 1,56 volt.
Reaksi sel tersebut berlangsung spontan.
Logam perak berfungsi sebagai katode.
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
4
4.8 (6 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia