Tipe molekul dapat dirumuskan sebagai berikut.
AXmEn
m adalah jumlah PEI, sedangkan n adalah jumlah PEB. Untuk menentukan jumlah PEI dan PEB, struktur Lewis suatu spesi perlu digambarkan terlebih dahulu. Oleh karena itu, langkah untuk mengerjakan soal ini adalah sebagai berikut.
Langkah 1: menentukan tipe molekul tiap spesi
JO2
Unsur J memiliki 6 elektron valensi dan O terletak di golongan VIA (memiliki 6 elektron valensi juga). Struktur Lewis JO2 dapat digambarkan sebagai berikut.
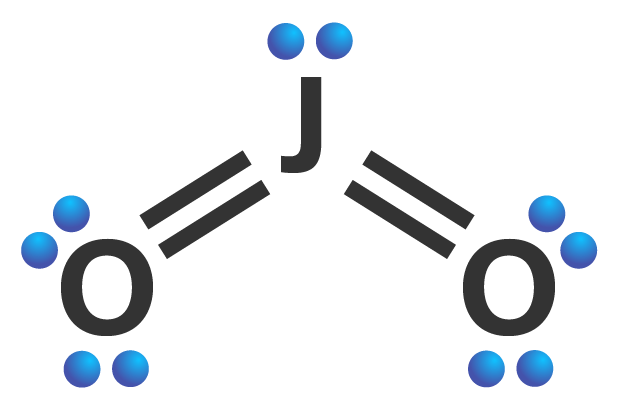
Pada JO2, 2 elektron valensi dari unsur J digunakan bersama dengan 2 elektron valensi dari unsur O membentuk ikatan kovalen rangkap dua masing-masing di sebelah kiri dan kanan. Dua ikatan kovalen rangkap dua menandakan 2 PEI. Selain itu, atom pusat J memiliki 1 PEB. Oleh karena itu, tipe molekul dari JO2 adalah AX2E.

Unsur L memiliki 5 elektron valensi dan unsur H terletak di golongan IA (memiliki 1 elektron valensi). Muatan −1 pada LH2− menunjukkan adanya penambahan 1 elektron valensi di atom pusat L. Struktur Lewis ion LH2− dapat digambarkan sebagai berikut.
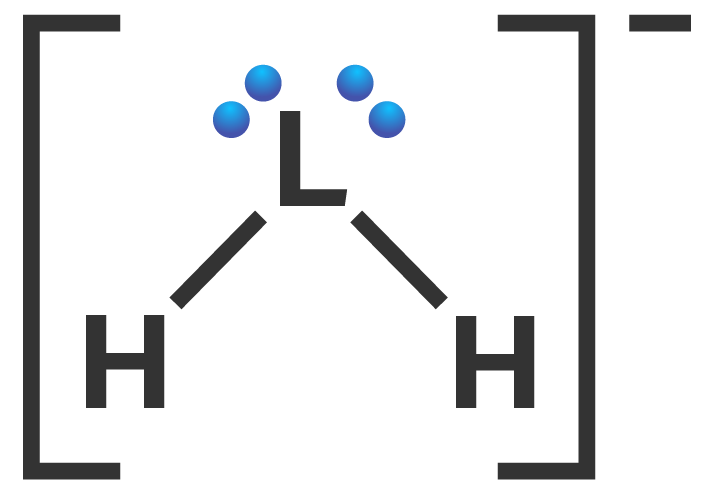
Pada LH2−, 1 elektron valensi dari unsur L digunakan bersama dengan 1 elektron valensi dari unsur H membentuk ikatan kovalen tunggal masing-masing di sebelah kiri dan kanan. Dua ikatan kovalen tunggal menandakan 2 PEI. Selain itu, atom pusat N memiliki 2 PEB. Oleh karena itu, tipe molekul LH2− adalah AX2E2.
MF2
Unsur M memiliki 8 elektron valensi dan unsur F terletak di golongan VIIA (memiliki 7 elektron valensi). Struktur Lewis MF2 dapat digambarkan sebagai berikut.

Pada MF2, 1 elektron valensi dari unsur M digunakan bersama dengan 1 elektron valensi dari unsur F membentuk ikatan kovalen tunggal masing-masing di sebelah kiri dan kanan. Dua ikatan kovalen tunggal menandakan 2 PEI. Selain itu, atom pusat M memiliki 3 PEB. Oleh karena itu, tipe molekul MF2 adalah AX2E3.
Langkah 2: menentukan spesi yang memiliki tipe molekul yang sama dengan H2O.
Unsur H terletak di golongan IA (memiliki 1 elektron valensi), sedangkan unsur O terletak di golongan VIA (memiliki 6 elektron valensi). Struktur Lewis H2O dapat digambarkan sebagai berikut.
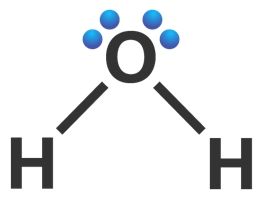
Pada H2O, 1 elektron valensi dari unsur O digunakan bersama dengan 1 elektron valensi dari unsur H membentuk ikatan kovalen tunggal masing-masing di sebelah kiri dan kanan. Dua ikatan kovalen tunggal menandakan 2 PEI. Selain itu, atom pusat O memiliki 2 PEB. Oleh karena itu, tipe molekul dari H2O adalah AX2E2. Berdasarkan tiga spesi pada soal, ion LH2− memiliki tipe molekul yang sama seperti H2O.
Dengan demikian, spesi yang memiliki tipe molekul yang sama dengan H2O adalah  saja.
saja.
Jadi, jawaban yang tepat adalah B.



















