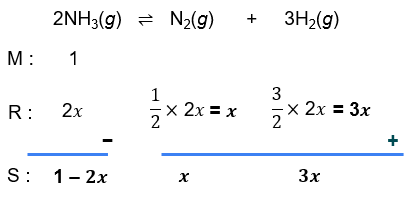Iklan
Pertanyaan
Dalam ruang 1 liter, sebanyak 17 gram gas NH 3 ( M r = 17 ) terurai menurut reaksi: 2 NH 3 ( g ) ⇌ N 2 ( g ) + 3 H 2 ( g ) Bila pada keadaan setimbang diperoleh perbandingan mol NH 3 : N 2 = 2 : 1 , tentukan besarnya: derajat disosiasi ( α ) NH 3 K c
Dalam ruang 1 liter, sebanyak 17 gram gas terurai menurut reaksi:
Bila pada keadaan setimbang diperoleh perbandingan mol , tentukan besarnya:
- derajat disosiasi
-
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
31
5.0 (3 rating)
ER
Enha Rania Sekar Ayu Ramadhani
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia