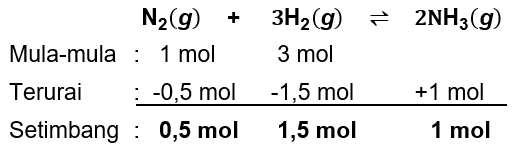Iklan
Pertanyaan
Campuran gas nitrogen dan hidrogen dengan perbandingan mol 1 : 3 direaksikan hingga terjadi reaksi kesetimbangan: N 2 ( g ) + 3 H 2 ( g ) ⇌ 2 NH 3 ( g ) Pada saat setimbang, 50% dari nitrogen telah bereaksi dan tekanan total ruangan adalah p . Tekanan parsial gas amonia di dalam kesetimbangan adalah ....
Campuran gas nitrogen dan hidrogen dengan perbandingan mol 1 : 3 direaksikan hingga terjadi reaksi kesetimbangan:
Pada saat setimbang, 50% dari nitrogen telah bereaksi dan tekanan total ruangan adalah p. Tekanan parsial gas amonia di dalam kesetimbangan adalah ....
Iklan
SL
S. Lubis
Master Teacher
Mahasiswa/Alumni Universitas Sumatera Utara
Jawaban terverifikasi
9
5.0 (14 rating)
ES
Etin Suryatin
Ini yang aku cari! Bantu banget Makasih ❤️
ID
Ivan Dwi Rizky Saputra
sangat membantu Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia