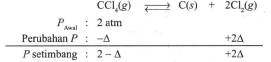Iklan
Pertanyaan
Gas CCl 4 pada suhu 700 K dapat terurai sesuai dengan reaksi berikut: CCl 4 ( g ) ⇌ C ( s ) + 2 Cl 2 ( g ) △ H ∘ = 106 , 7 kJ dengan nilai K p = 0 , 76 Pada suhu 700 K, sejumlah gas dimasukkan ke dalam wadah sehingga tekanannya 2 atm. Gas tersebut didiarnkan hingga mencapai kesetimbangan pada suhu 700 K. a. (i) Tuliskan pemyataan K p untuk reaksi tersebut. (ii) Bagaimananilai kesetimbangan tersebut bila suhunya dinaikkan menjadi 800 K, lebih besar atau lebih kecil? Berikan penjelasannya. b. Dalam keadaan setimbang pada 700 K: (i) Berapa fraksi mol yang berubah menjadi C ( s ) dan Cl 2 ( g ) ? (ii) Tentukan tekanan parsial dan Cl 2 . Bila reaksi tersebut dilakukan dalam wadah yang bervolume 5 L, c. (i) Berapa mol gas yang dimasukkan ke dalam wadah tersebut? (ii) Berapa banyaknya yang terbentuk setelah tercapai kesetimbangan pada 700 K? Diketahui: tetapan gas universal R = 8 , 315 J mol − 1 K − 1 = 0 , 08205 L atm mol − 1 K − 1 .
Gas pada suhu 700 K dapat terurai sesuai dengan reaksi berikut:
dengan nilai
Pada suhu 700 K, sejumlah gas dimasukkan ke dalam wadah sehingga tekanannya 2 atm. Gas tersebut didiarnkan hingga mencapai kesetimbangan pada suhu 700 K.
a. (i) Tuliskan pemyataan untuk reaksi tersebut.
(ii) Bagaimana nilai kesetimbangan tersebut bila suhunya dinaikkan menjadi 800 K, lebih besar atau lebih kecil? Berikan penjelasannya.
b. Dalam keadaan setimbang pada 700 K:
(i) Berapa fraksi mol yang berubah menjadi dan ?
(ii) Tentukan tekanan parsial dan . Bila reaksi tersebut dilakukan dalam wadah yang bervolume 5 L,
c. (i) Berapa mol gas yang dimasukkan ke dalam wadah tersebut?
(ii) Berapa banyaknya yang terbentuk setelah tercapai kesetimbangan pada 700 K? Diketahui: tetapan gas universal
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
12
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia