Iklan
Pertanyaan
Informasi berikut digunakan untuk menjawab soal nomor 18-20.
Percobaan laju suatu reaksi dilakukan di laboratorium. Persamaan reaksi antara gas dan CO dalam bejana tertutup, yaitu:
Data percobaan diberikan pada tabel berikut.
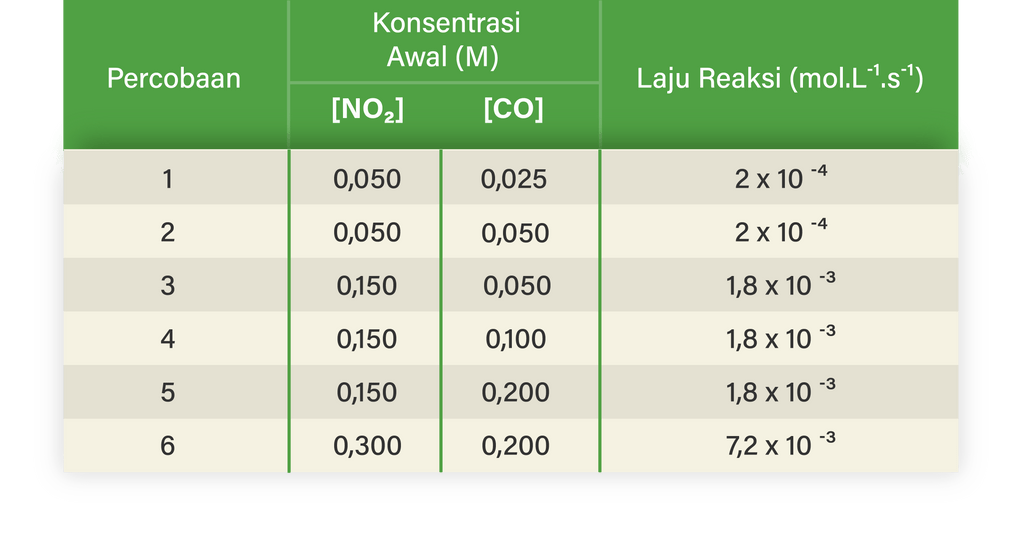
Besar tetapan laju reaksi adalah ...
Besar tetapan laju reaksi adalah ...
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















