Iklan
Pertanyaan
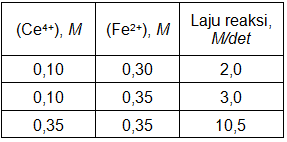
Laju reaksi oksida besi (II) oleh setrium(IV) pada reaksi : Ce 4 + ( a q ) + Fe 2 + ( a q ) → Ce 3 + ( a q ) + Fe 3 + ( a q ) Diperoleh data sebagai berikut : Pernyataan berikut yang benar adalah .... Laju = k [ Ce 4 + ] [ Fe 2 + ] K = 66 , 67 L mol − 1 det − 1 Orde reaksi total = 2 K tetap pada berbagai suhu (SPMB 2007/IPA/59)
Laju reaksi oksida besi (II) oleh setrium(IV) pada reaksi :
Diperoleh data sebagai berikut :
Pernyataan berikut yang benar adalah ....
- Orde reaksi total = 2
- tetap pada berbagai suhu
(SPMB 2007/IPA/59)
1, 2, dan 3 SAJA yang benar.
1 dan 3 SAJA yang benar.
2 dan 4 SAJA yang benar.
HANYA 4 yang benar.
SEMUA pilihan benar.
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
2
4.0 (2 rating)
EI
Evelyn Iyn
Lumayan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia