Iklan
Pertanyaan
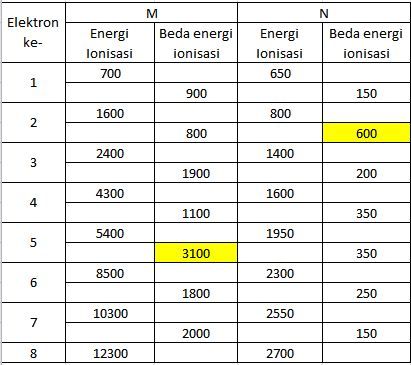
Berikut ini diketahui delapan energi ionisasi unsur M dan N (kJ/mol): 700, 1.600, 2.400, 4.300, 5.400, 8.500, 10.300, 12.300 untuk unsur M dan 650, 800, 1.400, 1.600, 1.950, 2.300, 2.550, 2.700 untuk unsur N . Jika unsur M dan N merupakan golongan A dan keduanya berikatan, maka akan membentuk ikatan ...
Berikut ini diketahui delapan energi ionisasi unsur dan (kJ/mol): 700, 1.600, 2.400, 4.300, 5.400, 8.500, 10.300, 12.300 untuk unsur dan 650, 800, 1.400, 1.600, 1.950, 2.300, 2.550, 2.700 untuk unsur . Jika unsur dan merupakan golongan A dan keduanya berikatan, maka akan membentuk ikatan ...
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia