Bilangan kuantum adalah bilangan yang menyatakan elektron terakhir dalam suatu konfigurasi elektron. Untuk mengetahui letak periode dan golongan suatu unsur, bilangan kuantum terlebih dahulu diubah mejadi sebuah elektron sehingga diperoleh konfigurasi elektron secara utuh.
(1) n=3, l = 1 , m = + 1, s = + 21
Untuk mengubah bilangan kuantum tersebut maka dilakukan analisis :
- n = 3, maka kulit terakhirnya adalah 3.
- l = 1, maka orbitalnya adalah p.
- m = p, maka posisi elektron terakhir berada pada orbital nomor +1.
- s =+ 21 , maka arah elektron ke atas.
Jika hasil analisis tersebut digambarkan maka akan menjadi :
3p5

Sehingga diketahui bahwa konfigurasi elektron unsur tersebut adalah
1s2 2s2 2p6 3s2 3p5atau [Ne] 3s2 3p5
Unsur terletak pada golongan VIIA.
(2) n = 5, l = 0, m = 0, s = +21
Untuk mengubah bilangan kuantum tersebut maka dilakukan analisis :
- n = 5, maka kulit terakhirnya adalah 5.
- l = 0, maka orbitalnya adalah s.
- m = 0, maka posisi elektron terakhir berada pada orbital nomor 0.
- s =+ 21 , maka arah elektron ke atas.
Jika hasil analisis tersebut digambarkan maka akan menjadi :
5s1

Sehingga diketahui bahwa konfigurasi elektron unsur tersebut adalah
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s1atau [Kr] 5s1
Unsur terletak pada golongan IA.
(3) n = 5, l = 1, m = + 1, s = +21
Untuk mengubah bilangan kuantum tersebut maka dilakukan analisis :
- n = 5, maka kulit terakhirnya adalah 5.
- l = 1, maka orbitalnya adalah p.
- m =+1, maka posisi elektron terakhir berada pada orbital nomor +1
- s =+ 21 , maka arah elektron ke atas.
Jika hasil analisis tersebut digambarkan maka akan menjadi :
5p5
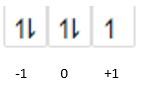
Sehingga diketahui bahwa konfigurasi elektron unsur tersebut adalah
[Kr] 4d10 5s2 5p5
Unsur terletak pada golongan VIIA.
(4) n = 5, l = 0, m = 0, s = -21
Untuk mengubah bilangan kuantum tersebut maka dilakukan analisis :
- n = 5, maka kulit terakhirnya adalah 5.
- l = 0, maka orbitalnya adalah s.
- m =0, maka posisi elektron terakhir berada pada orbital nomor 0.
- s =- 21 , maka arah elektron ke bawah.
Jika hasil analisis tersebut digambarkan maka akan menjadi :
5s2

Sehingga diketahui bahwa konfigurasi elektron unsur tersebut adalah
[Kr] 5s2
Unsur terletak pada golongan IIA.
Bilangan kuantum no 1 dan 3 terletak pada satu golongan yang sama yaitu VIIA.
Dengan demikian, bilangan kuantum elektron terakhir unsur yang tidak terletak dalam satu golongan adalah no 2 dan 4.
Jadi, jawaban yang benar adalah C.



















