Iklan
Pertanyaan
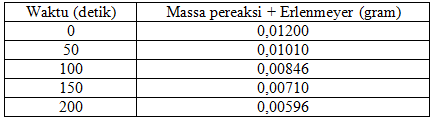
Asam format bereaksi dengan bromin pada suhu 25 °C menurut persamaan reaksi berikut. HCOOH ( l ) + Br 2 ( aq ) → 2 Br ( aq ) + 2 H ( aq ) + + CO 2 ( aq ) Pengamatan yang dilakukan pada reaksi tersebut menghasilkan data sebagai berikut. a.Tentukan laju reaksi rata-rata saat Br 2 bereaksi dengan asam format dalam interval waktu: i) 0 - 50 detik ii) 50 - 100 detik iii) 100 - 150 detik iv) 150 - 200 detik b. Bagaimana kecenderungan laju reaksi rata - rata seiring bertambahnya periode waktu reaksi? Mengapa demikian?
Asam format bereaksi dengan bromin pada suhu 25 °C menurut persamaan reaksi berikut.
Pengamatan yang dilakukan pada reaksi tersebut menghasilkan data sebagai berikut.
a. Tentukan laju reaksi rata-rata saat bereaksi dengan asam format dalam interval waktu:
i) 0 - 50 detik
ii) 50 - 100 detik
iii) 100 - 150 detik
iv) 150 - 200 detik
b. Bagaimana kecenderungan laju reaksi rata - rata seiring bertambahnya periode waktu reaksi? Mengapa demikian?
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
5
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia