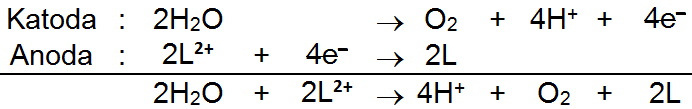Elektrolisis adalah reaksi redoks yang tidak bisa berlangsung spontan. Sel elektrolisis menggunakan listrik untuk melangsungkan reaksinya. Hal ini kebalikan dari sel Volta yang berlangsung spontan dan menghasilkan energi listrik. Pada sel elektrolisis katoda bermuatan negatif dan anoda bermuatan positif. Reaksi yang terjadi sama seperti pada sel Volta, yaitu reaksi reduksi pada katoda dan reaksi oksidasi pada anoda. Elektron mengalir memasuki larutan melalui kutub negatif (katoda).
Untuk dapat menjawab soal di atas, maka terlebih dahulu dibuat persamaan reaksi elektrolisis  . Larutan
. Larutan  dielektrolisis denga menggunakan elektroda Pt yang bersifat inert, sehingga elektroda tidak ikut bereksi dalam proses elektrolisis. Reaksi yang terjadi pada elektrolisis adalah sebagai berikut.
dielektrolisis denga menggunakan elektroda Pt yang bersifat inert, sehingga elektroda tidak ikut bereksi dalam proses elektrolisis. Reaksi yang terjadi pada elektrolisis adalah sebagai berikut.
Katoda : 
Anoda : 
Pada elektrolisis larutan  , logam L direduksi di katoda, sedangkan ion
, logam L direduksi di katoda, sedangkan ion  tidak teroksidasi di anoda melainkan molekul air yang teroksidasi. Reaksi oksidasi air pada anoda menghasilkan gas oksigen (
tidak teroksidasi di anoda melainkan molekul air yang teroksidasi. Reaksi oksidasi air pada anoda menghasilkan gas oksigen ( ) dan ion
) dan ion  . Ion
. Ion  yang dihasilkan selanjutnya dititrasi dengan
yang dihasilkan selanjutnya dititrasi dengan  0,2 M.
0,2 M.
Sebelum menghitung massa atom relatif logam L, maka perlu disetarakan terlebih dahulu persamaan reaksi elektrolisisnya dengan cara menyamakan jumlah elektron. Reaksi reduksi pada katoda perlu dikalikan 2 agar jumlah elektron yang terlibat sama dengan jumlah elektron pada reaksi oksidasi, yaitu sebanyak 4 elektron. Persamaan reaksi elektrolisis yang telah setara adalah sebagai berikut.
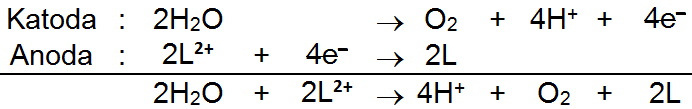
Ion  yang dihasilkan dari elektrolisis kemudian dititrasi dengan larutan
yang dihasilkan dari elektrolisis kemudian dititrasi dengan larutan  0,2 M. Jumlah mol ion
0,2 M. Jumlah mol ion  yang dititrasi dapat dihitung dari proses titrasi. Proses titrasi dilakukan dengan mereaksikan larutan asam dengan larutan basa agar menjadi netral. Prinsip dasar dari titrasi asam-basa yaitu mol
yang dititrasi dapat dihitung dari proses titrasi. Proses titrasi dilakukan dengan mereaksikan larutan asam dengan larutan basa agar menjadi netral. Prinsip dasar dari titrasi asam-basa yaitu mol  = mol
= mol  . Dengan demikian, mol ion
. Dengan demikian, mol ion  yang dititrasi dapat dihitung dengan cara berikut.
yang dititrasi dapat dihitung dengan cara berikut.

Selanjutnya, untuk dapat menentukan massa atom relatif logam L, maka perlu dicari dahulu mol logam L hasil elektrolisis. Mol logam L hasil elektrolisis didapatkan dengan perbandingan koefisien reaksi antara  dan koefisien logam L dalam persamaan reaksi elektrolisis berikut.
dan koefisien logam L dalam persamaan reaksi elektrolisis berikut.

Pada persamaan reaksi di atas, koefisien ion  adalah 4 dan kofisien logam L adalah 2, maka jumlah mol logam L adalah sebagai berikut.
adalah 4 dan kofisien logam L adalah 2, maka jumlah mol logam L adalah sebagai berikut.

Setelah diketahui jumlah mol logam L, maka massa atom relatif logam L dihitung dengan cara berikut.

Dengan demikian, maka maka massa atom relatif logam L adalah 65.
Jadi, jawaban yang tepat adalah E.