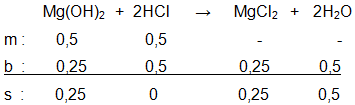Iklan
Pertanyaan
0,5 mol Mg ( OH ) 2 bereaksi dengan 0,5 mol HCl sesuai persamaan reaksi: Mg ( OH ) 2 ( a q ) + 2 HCl ( a q ) → MgCl 2 ( a q ) + 2 H 2 O ( l ) Tentukan: a. pereaksi pembatas b. pereaksi yang sisa c. mol MgCl 2 dan mol H 2 O
0,5 mol bereaksi dengan 0,5 mol HCl sesuai persamaan reaksi:
Tentukan:
a. pereaksi pembatas
b. pereaksi yang sisa
c. mol dan mol
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
32
4.8 (40 rating)
NF
Nadzif Feda Al Farisy
Pembahasan lengkap banget
MD
Muhamad Dwi Saputra
Pembahasan lengkap banget Ini yang aku cari!
e
ell
Ini yang aku cari! Pembahasan lengkap banget
CE
Chairani Eka
Makasih ❤️
DC
Dhea Cahyaningrum
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia