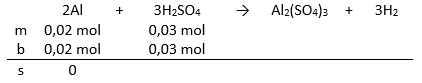Iklan
Pertanyaan
Volume larutan H 2 SO 4 0,1 M yang diperlukan untuk melarutkan sampai habis 0,54 gram logam alumunium ( A r Al = 27) adalah . . . .
Volume larutan 0,1 M yang diperlukan untuk melarutkan sampai habis 0,54 gram logam alumunium ( Al = 27) adalah . . . .
100 ml
200 ml
300 ml
400 ml
500 ml
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
6
3.6 (3 rating)
AA
Andin Afit Pradita
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia