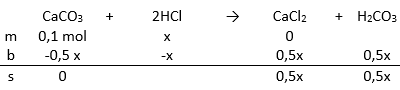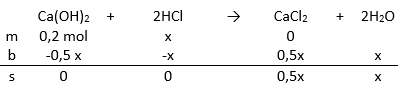Volume larutan HCl 2 M yang dibutuhkan untuk melarutkan 25 gram campuran tersebut adalah 300 ml (opsi B).
Soal di atas menyatakan bahwa terjadi reaksi antara CaCO3 dengan HCl serta terjadi juga reaksi antara Ca(OH)2 dengan HCl. Suatu campuran yang terdiri dari 40% CaCO3 dan 60% Ca(OH)2 direaksikan dengan HCl menggunakan persamaan reaksi sebagai berikut:
CaCO3+2HCl→CaCl2+H2CO3
Ca(OH)2+2HCl→CaCl2+2H2O
Jika terdapat 25 gram campuran, maka nilai massa dan mol CaCO3 dan Ca(OH)2 adalah sebagai berikut:
Perhitungan massa CaCO3 dan Ca(OH)2:
m CaCO3 = 25 gram × 40%m CaCO3 = 10 gramm Ca(OH)2 = 25 gram × 60%m CaCO3 = 15 gram
Perhitungan mol CaCO3 dan Ca(OH)2:
n CaCO3 = Mr CaCO3m CaCO3n CaCO3 = Ar Ca+Ar C+3(Ar O)10 gramn CaCO3 = 40+12+3(16)10 gramn CaCO3 = 100 molgram10 gramn CaCO3 = 0,1 moln Ca(OH)2= Mr Ca(OH)2m Ca(OH)2n Ca(OH)2= Ar Ca+2(Ar O)+2(Ar H)15 gramn Ca(OH)2= 40+2(16)+2(1)15 gramn Ca(OH)2= 74 molgram15 gramn Ca(OH)2= 0,2 mol
Untuk dapat menentukan jumlah mol HCl yang diperlukan pada pelarutan kedua senyawa tersebut, maka kita perlu menulis reaksi kimia beserta mol mula-mula(m), mol bereaksi(b) dan mol sisa(s) dari masing-masing zat.
Reaksi mbs CaCO3 dan HCl
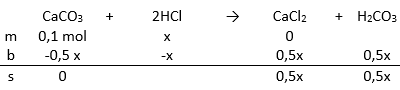
menghitung mol HCl pada reaksi CaCO3 dan HCl:0,1−0,5x=0x =0,50,1x =0,2 n HCl=0,2 mol
Reaksi mbs Ca(OH)2 dan HCl
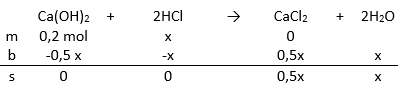
menghitung mol HCl pada reaksi Ca(OH)2 dan HCl:0,2−0,5x=0x =0,50,2x =0,4 n HCl=0,4 mol
Perhitungan mol total HCl:
0,2 mol + 0,4 mol = 0,6 mol
Perhitungan volume total HCl:
V total HCl=M HClmol total HClV total HCl=2M0,6 molV total HCl=0,3 L=300 ml
Sehingga, volume larutan HCl 2 M yang dibutuhkan untuk melarutkan 25 gram campuran tersebut adalah 300 ml (opsi B).