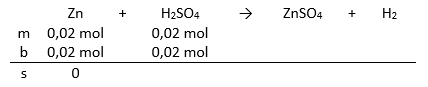Iklan
Pertanyaan
Jika 1,3 gram logam seng ( A r Zn = 65) direaksikan dengan larutan 0,5 M asam sulfat, maka volume larutan asam sulfat yang diperlukan adalah....
Jika 1,3 gram logam seng ( Zn = 65) direaksikan dengan larutan 0,5 M asam sulfat, maka volume larutan asam sulfat yang diperlukan adalah....
10 ml
20 ml
30 ml
40 ml
50 ml
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia