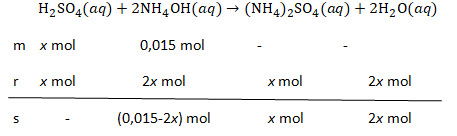Iklan
Pertanyaan
Volume asam sulfat 0,05 M yang harus ditambahkan ke dalam 100 mL NH 3 0,15 M ( K b = 1 0 − 5 ) agar diperoleh campuran dengan pH = 6 - log 3 adalah ....
Volume asam sulfat 0,05 M yang harus ditambahkan ke dalam 100 mL 0,15 M agar diperoleh campuran dengan pH = 6 - log 3 adalah ....
10 mL
15 mL
20 mL
25 mL
30 mL
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
2
3.3 (3 rating)
VV
Vivi Vii
Ga bisa kebuka
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia