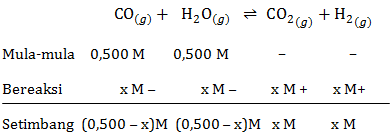Iklan
Pertanyaan
Untuk reaksi: CO ( g ) + H 2 O ( g ) ⇌ CO 2 ( g ) + H 2 ( g ) Nilai tetapan kesetimbangan K c pada suhu 250 o C adalah 1,845. Sebanyak 0,500 mol CO dan 0,500 mol H 2 O diisikan ke dalam wadah 1L pada suhu ini dan dibiarkan bereaksi sampai keadaan kesetimbangan. Berapakah konsentrasi semua gas pada keadaan setimbang?
Untuk reaksi:
Nilai tetapan kesetimbangan Kc pada suhu 250 oC adalah 1,845. Sebanyak 0,500 mol CO dan 0,500 mol H2O diisikan ke dalam wadah 1L pada suhu ini dan dibiarkan bereaksi sampai keadaan kesetimbangan. Berapakah konsentrasi semua gas pada keadaan setimbang?
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
3
5.0 (5 rating)
Gg
Goklan ganda manurung
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia