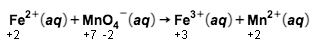Iklan
Pertanyaan
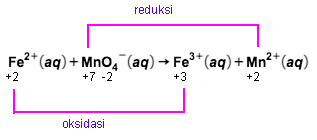
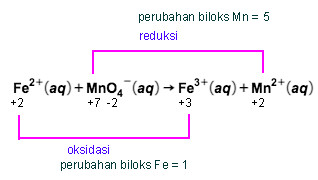
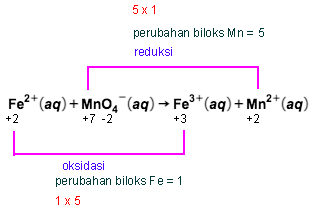
Untuk mengoksidasi ion besi(II) dalam 100 mL larutan FeSO 4 diperlukan larutan KMnO 4 0,1 M sebanyak 50 mL. Berapa gram yang terdapat dalam tiap liter larutan tersebut? ( A r Fe = 56 , S = 32 , dan O = 16 )
Untuk mengoksidasi ion besi(II) dalam 100 mL larutan diperlukan larutan 0,1 M sebanyak 50 mL. Berapa gram yang terdapat dalam tiap liter larutan
tersebut? ()
Iklan
LA
L. Avicenna
Master Teacher
Mahasiswa/Alumni Institut Teknologi Bandung
Jawaban terverifikasi
7
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia