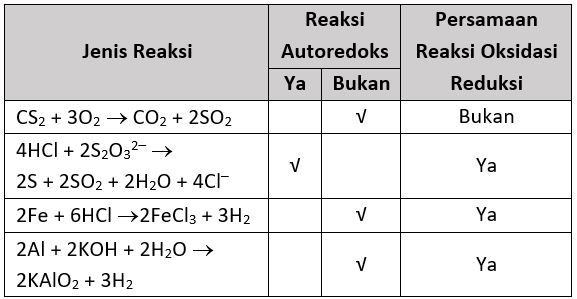
Reaksi autoredoks atau reaksi disproporsionasi adalah reaksi redoks yang melibatkan reduktor (spesi teroksidasi) dan oksidator (spesi tereduksi) yang sama. Oleh karena itu, untuk menentukan mana yang reaksi autoredoks,, harus diketahui atom yang mengalami perubahan bilangan oksidasi.
Reaksi 1:
Atom O: tidak mengalami perubahan bilangan oksidasi karena tidak ada senyawa peroksida/superoksida dan unsur bebas.
Atom S: pada CS2, bilangan oksidasi S adalah -2, sedangkan pada SO2:
(1×bo S)+(2×bo O)bo S+(2×−2)bo S−4bo S====000+4
Berarti, atom S mengalami kenaikan bilangan oksidasi (oksidasi) dari -2 menjadi +4 sehingga CS2 merupakan reduktor dan SO2 merupakan hasil oksidasi.
Atom C:
pada CS2:
(1×bo C)+(2×bo S)bo C+(2×−2)bo C−4bo C====000+4
pada CO2:
(1×bo C)+(2×bo O)bo C+(2×−2)bo C−4bo C====000+4
Atom C tidak mengalami perubahan bilangan oksidasi.
Dengan demikian, reaksi 1 bukan merupakan reaksi redoks.
Reaksi 2
Atom H: tidak mengalami perubahan bilangan oksidasi (tetap +1) karena tidak ada senyawa hidrida dan unsur bebas.
Atom O: tidak mengalami perubahan bilangan oksidasi (tetap -2) karena tidak ada senyawa peroksida/superoksida dan unsur bebas.
Atom Cl: tidak mengalami perubahan bilangan oksidasi (tetap -1) karena tidak ada senyawa oksihalogen dan unsur bebas.
Atom S:
pada S2O32−, jumlah bilangan oksidasinya adalah -2, maka:
(2×bo S)+(3×bo O)(2×bo S)+(3×−2)(2×bo S)−62×bo Sbo Sbo S======−2−2−2−2+62+4+2
pada S, merupakan unsur bebas sehingga bilangan oksidasi S adalah 0.
pada SO2, jumlah bilangan oksidasi adalah 0, maka:
(1×bo S)+(2×bo O)bo S+(2×−2)bo S−4bo S====000+4
Atom S mengalami penurunan bilangan oksidasi (reduksi) dari +2 menjadi 0 dan kenaikan bilangan oksidasi (oksidasi) dari +2 menjadi +4. Berarti, S2O32− merupakan oksidator dan reduktor dan reaksi ini merupakan reaksi autoredoks.
Reaksi 3
Atom Cl: tidak mengalami perubahan bilangan oksidasi (tetap -1) karena tidak ada senyawa oksihalogen dan unsur bebas.
Atom Fe: pada Fe, merupakan unsur bebas sehingga bilangan oksidasinya adalah 0; sedangkan pada FeCl3, jumlah bilangan oksidasinya 0, maka:
(1×bo Fe)+(3×bo Cl)bo Fe+(3×−1)bo Fe−3bo Fe====000+3
Berarti atom Fe mengalami kenaikan bilangan oksidasi (oksidasi) dari 0 menjadi +3 dan Fe merupakan reduktor.
Atom H: pada HCl, memiliki bilangan oksidasi +1; sedangkan pada H2, merupakan unsur bebas sehingga bilangan oksidasinya 0. Berarti atom H mengalami penurunan bilangan oksidasi (reduksi) dari +1 menjadi 0 dan HCl merupakan oksidator.
Dengan demikian, reaksi 3 merupakan reaksi redoks, tetapi bukan reaksi autoredoks.
Reaksi 4
Atom K: merupakan logam golongan IA, yang tidak mengalami perubahan bilangan oksidasi (tetap +1) karena tidak ada unsur bebas.
Atom O: tidak mengalami perubahan bilangan oksidasi (tetap -2) karena tidak ada senyawa peroksida/superoksida dan unsur bebas.
Atom Al: pada Al, merupakan unsur bebas sehingga bilangan oksidasinya adalah 0; sedangkan pada KAlO2, jumlah bilangan oksidasinya 0, maka:
(1×bo K)+(1×bo Al)+(2×bo O)(1×+1)+bo Al+(2×−2)+1+bo Al−4bo Al−3bo Al=====0000+3
Berarti atom Al mengalami kenaikan bilangan oksidasi (oksidasi) dari 0 menjadi +3 dan Al merupakan reduktor.
Atom H: pada KOH, memiliki bilangan oksidasi +1; sedangkan pada H2, merupakan unsur bebas sehingga bilangan oksidasinya 0. Berarti atom H mengalami penurunan bilangan oksidasi (reduksi) dari +1 menjadi 0 dan KOH merupakan oksidator.
Dengan demikian, reaksi 4 merupakan reaksi redoks, tetapi bukan reaksi autoredoks.
Jadi, tabel yang telah dilengkapi: