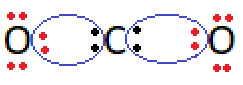Bentuk molekul untuk CO2
Karbon(C) merupakan unsur dengan nomor atom 6 sehingga konfigurasinya yaitu:

Maka berdasarkan teori hibridisasi bentuk molekul CO2 dapat dijelaskan dengan menggambarkan masing-masing orbital pada elektron valensi C yaitu  sebagai berikut:
sebagai berikut:
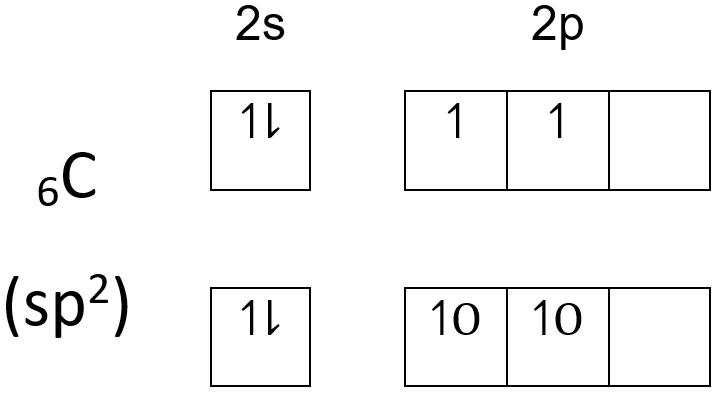
Hibridisasi CO2 adalah sp2. Bentuk molekul jika berdasarkan teori hibridisasi molekul sp2 adalah segitiga planar.
Jika bentuk molekul diramalkan berdasarkan teori domain elektron maka:
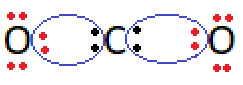
Terdapat 2 pasangan elektron ikatan (PEI) dan tidak ada pasangan elektron bebas (PEB) maka domain elektronnya yaitu AX2. Berdasarkan teori VSEPR bentuk molekul AX2 adalah linear.
Bentuk molekul untuk SnCl4
Timah (Sn) merupakan unsur dengan nomor atom 50 sehingga konfigurasinya yaitu:

Maka berdasarkan teori hibridisasi bentuk molekul SnCl4 dapat dijelaskan dengan menggambarkan masing-masing orbital pada elektron valensi Sn yaitu  sebagai berikut:
sebagai berikut:
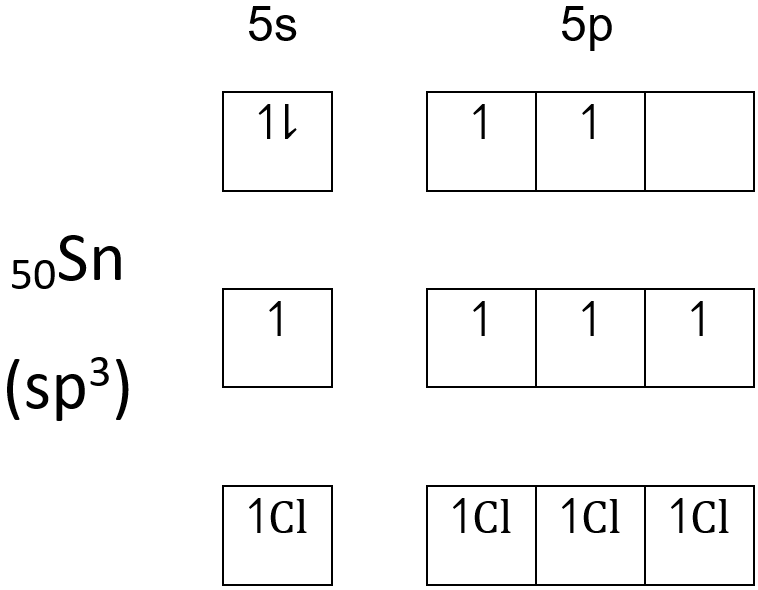
Hibridisasi SnCl4 adalah sp3. Bentuk molekul jika berdasarkan teori hibridisasi molekul sp3 adalah tetrahedral.
Jika bentuk molekul diramalkan berdasarkan teori domain elektron maka:
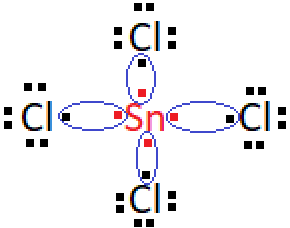
Terdapat 4 pasangan elektron ikatan (PEI) dan 0 pasangan elektron bebas (PEB) maka domain elektronnya yaitu AX4. Berdasarkan teori VSEPR bentuk molekul AX4 adalah tetrahedral.