Iklan
Pertanyaan
Suatu unsur dapat melepaskan tujuh elektron secara berturut-turut dengan energi ionisasi ( IE ) sebagai berikut (dalam kJ / mol ): I. Unsur tersebut memiliki3 elektron valensi. II. Unsur tersebut merupakan salah satu dari unsur-unsur golongan IVA. III. Konfigurasi elektron di kulit terluar: 3 d 2 4 s 2 IV. Jika unsur tersebut terletak di periode 4, maka nomor atom unsur tersebut adalah 32. Pemyataan yang benar mengenai unsur ini adalah ....
Suatu unsur dapat melepaskan tujuh elektron secara berturut-turut dengan energi ionisasi (IE) sebagai berikut (dalam ):
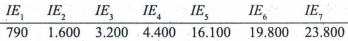
I. Unsur tersebut memiliki3 elektron valensi.
II. Unsur tersebut merupakan salah satu dari unsur-unsur golongan IVA.
III. Konfigurasi elektron di kulit terluar:
IV. Jika unsur tersebut terletak di periode 4, maka nomor atom unsur tersebut adalah 32.
Pemyataan yang benar mengenai unsur ini adalah ....
I, II, III, dan IV
I, II, dan III
I dan III
II dan IV
IV saja
Iklan
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia
















