Iklan
Pertanyaan
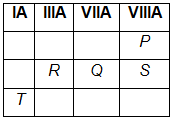
Konfigurasi elektron unsur P , Q , R , S , dan T dengan menggunakan prinsip aufbau adalah sebagai berikut. P : 1 s 2 Q : 1 s 2 2 s 2 2 p 5 R : 1 s 2 2 s 2 2 p 1 S : 1 s 2 2 s 2 2 p 6 T : 1 s 2 2 s 2 2 p 6 3 s 1 Tentukan unsur manakah yang: mempunyai energi ionisasi terbesar
Konfigurasi elektron unsur P, Q, R, S, dan T dengan menggunakan prinsip aufbau adalah sebagai berikut.
Tentukan unsur manakah yang:
mempunyai energi ionisasi terbesar
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
2
4.5 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia