Iklan
Iklan
Pertanyaan
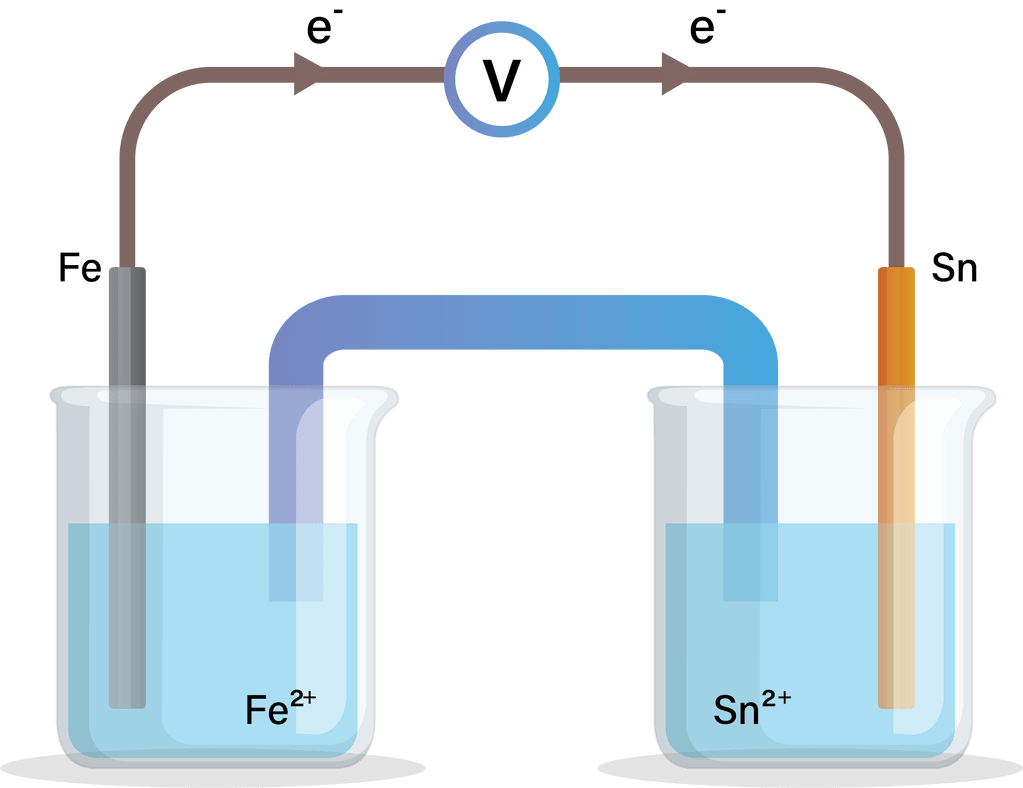
Suatu sel Volta terdiri atas elektrode Sn dan elektrode Fe yang dicelupkan dalam larutan ion logamnya dengan konsentrasi 1 M.Jika diketahui: Sn 2 + ( a q ) + 2 e − → Sn ( s ) E ∘ = − 0 , 14 V Fe 2 + ( a q ) + 2 e − → Fe ( s ) E ∘ = − 0 , 44 V a. Buatlahgambar diagram sel Volta tersebut. b.Tentukan anode dan katodenya. c. Tuliskan reaksi selnya. d. Tentukan nilai potensial selnya.
Suatu sel Volta terdiri atas elektrode Sn dan elektrode Fe yang dicelupkan dalam larutan ion logamnya dengan konsentrasi 1 M. Jika diketahui:
a. Buatlah gambar diagram sel Volta tersebut.
b. Tentukan anode dan katodenya.
c. Tuliskan reaksi selnya.
d. Tentukan nilai potensial selnya.
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
11
4.6 (10 rating)
d
dimasss
Ini yang aku cari!
RD
RIFAI DARMAWAN
Jawaban tidak sesuai
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia