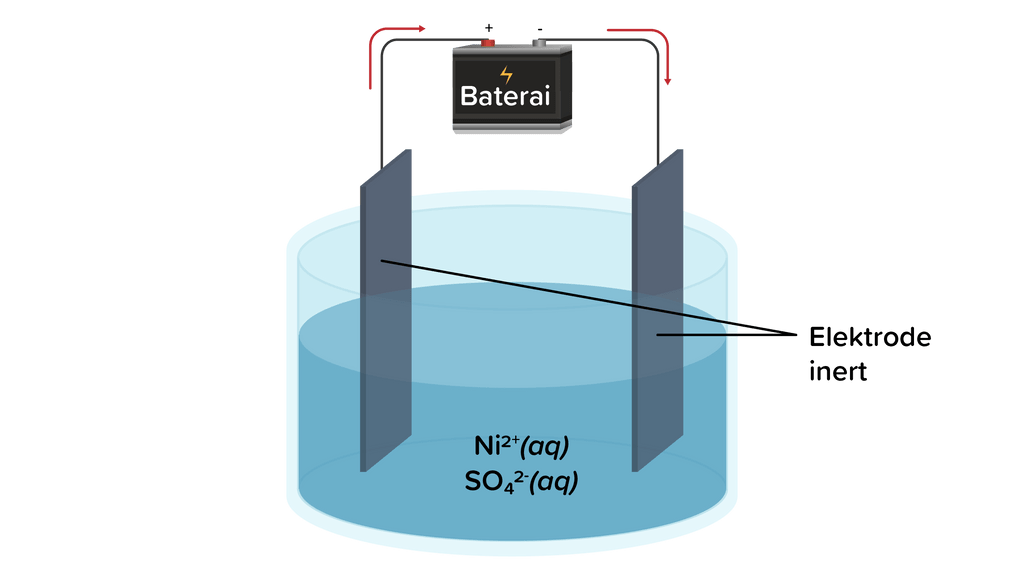
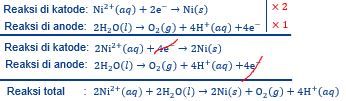A. Menentukan sel galvani atau sel elektrolisis harus diawali dengan memahami perbedaan antara keduanya.
Susunan sel galvani (sel volta)
- Reduktor dan oksidatornya dipisahkan sehingga pemindahan elektron tidak secara langsung tetapi melalui kawat penghantar
- Kedua larutan dihubungkan dengan suatu jembatan garam
- Elektrode dicelupkan dalam larutan yang mengandung ion tersebut
Susunan sel elektrolisi
- Terdiri dari sebuah wadah, elektrode, elektrolit dan sumber searah
Berdasarkan penjelasan di atas, gambar susunan sel elektrokimia berikut merupakan sel elektrolisis sebab hanya terdiri dari satu wadah, tidak melibatkan jembatan garam serta kawat penghantar listrik seperti susunan sel volta
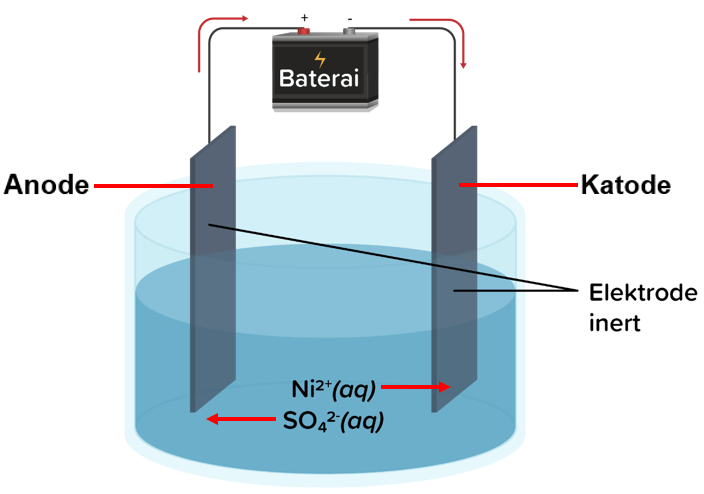
B. Bagian katode dan anodenya, serta arah aliran ion
Anode
- Tempat terjadinya reaksi oksidasi (pelepasan elektron)
- Anode dihubungkan dengan kutub positif
- Pada susunan sel elektrolisis berikut (anode di sebelah kiri)
Katode
- Tempat terjadinya reaksi reduksi (pengikatan elektron)
- Katode dihubungkan dengan kutub negatif
- Pada susunan sel elektrolisis berikut (katode di sebelah kanan)
Arah aliran elektron dari anode ke katode, sebab di anode terjadi pelepasan elektron kemudian elektron diterima di katode sebab pada katode terjadi pengikatan elektron
C. Reaksi pada anode, katode, dan reaksi total
Katode : terjadi reaksi dengan ion-ion positif ( ), maka di katode terjadi reduksi ion
), maka di katode terjadi reduksi ion 
Reaksi di katode : 
Anode : terjadi reaksi dengan ion-ion negatif ( ). Pada anode yang teroksidasi yang jumlah oksigennya lebih sedikit, maka yang teroksidasi di anode adalah
). Pada anode yang teroksidasi yang jumlah oksigennya lebih sedikit, maka yang teroksidasi di anode adalah 
Reaksi di anode : 
Penentuan reaksi total sebagai berikut:
Pada anode dan katode terdapat perbedaan jumlah elektron, sehingga jumlah elektronnya perlu disamakan terlebih dahulu sebagai berikut
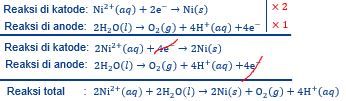
Reaksi total =

Jadi, sel tersebut merupakan sel elektrolisis, anode dan katode ditunjukkan pada gambar serta reaksi di anode, katode dan reaksi totalnya sebagai berikut:
Reaksi di katode : 
Reaksi di anode : 
Reaksi total :