Iklan
Pertanyaan
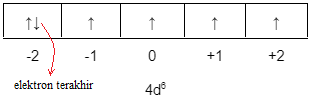
Suatu atom memiliki elektron terakhir dengan bilangan kuantum n = 4, l = 2, m = –2, s = − 2 1 . Jumlah orbital yang berisi elektron berpasangan dalam atom tersebut adalah ….
Suatu atom memiliki elektron terakhir dengan bilangan kuantum n = 4, l = 2, m = –2, s = . Jumlah orbital yang berisi elektron berpasangan dalam atom tersebut adalah ….
20
21
22
23
24
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
4.3 (13 rating)
F
Fatimatus
Pembahasan lengkap banget Mudah dimengerti Bantu banget Makasih ❤️
NS
Novelina Sihombing
Makasih ❤️
Tl
Tiya lestari
Jawaban tidak sesuai
AH
Anisa Humaira
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia