Bilangan kuantum adalah bilangan yang digunakan sebagai penentu kedudukan elektron dalam atom. Terdapat empat jenis bilangan kuantum yaitu:
- Bilangan kuantum utama (n), yang menunjukkan kulit atom.
- Bilangan kuantum azimuth (l), yang menunjukkan subkulit atom, nilai bilangan kuantum azimuth yang mungkin adalah besarnya (n-1). Tabel berikut menjelaskan nilai bilangan kuantum azimuth dan lambang subkulitnya:
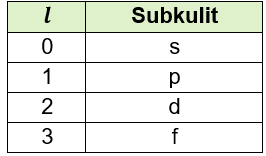
- Bilangan kuantum magnetik (m), yang menunjukkan jumlah orbital. Nilai dan banyaknya orbital yang mungkin adalah besarnya dalam rentang (-l) hingga (+l).
- Bilangan kuantum spin (s), yang menunjukkan orientasi elektron terhadap medan magnet di sekitarnya, nilai s memiliki 2 kemungkinan yaitu +21 dan −21.
Berdasarkan penjelasan tersebut maka:
a. Nilai spin elektron yang mungkin adalah +21 dan −21.
b. Tentukan konfigurasi elektron valensi atom yang mungkin!
Konfigurasi elektron valensi atom yang mungkin ada dua, yaitu pada bilangan kuantum n= 3, l= 2, m= +2, s= +21 dan n= 3, l= 2, m= +2, s= −21.
Pada n= 3, l= 2, m= +2, s= +21 elektron terakhirnya adalah 3d dan banyaknya elektronnya adalah:
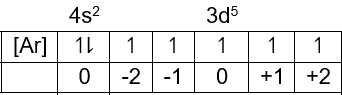
Jadi konfigurasi elektronnya adalah [Ar]4s23d5
Pada n= 3, l= 2, m= +2, s= −21 elektron terakhirnya adalah 3d dan banyaknya elektronnya adalah:
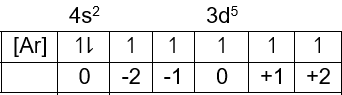
Jadi konfigurasi elektronnya adalah [Ar]4s23d10
c. Tentukan jumlah kulit dan subkulit yang digunakan!
Jumlah kulit ditunjukkan pada bilangan kuantum utama dan subkulit ditunjukkan pada bilangan kuantum azimuth. Karena n= 3 dan l= 2 maka jumlah kulit adalah 3 dan jumlah subkulit adalah 2.
d. Tentukan Z atom yang mungkin!
Z atom yang dimaksud adalah nomor atom, pada kemungkinan pertama dengan konfigurasi elektron [Ar]4s23d5, nomor atomnya adalah 18+2+5= 25. Dan pada kemungkinan kedua dengan konfigurasi elektron [Ar]4s23d10, nomor atomnya adalah 18+2+10= 30.
Jadi, jawaban untuk:
a. Nilai spin elektron yang mungkin adalah +21 dan −21.
b. Konfigurasi elektron valensi atom yang mungkin adalah:
[Ar]4s23d5 dan [Ar]4s23d10
c. Jumlah kulit yang digunakan adalah 3 dan subkulitnya adalah 2.
d. Nilai Z (nomor atom) yang mungkin adalah:
adalah:
Pada [Ar]4s23d5 nomor atomnya adalah 25
Pada [Ar]4s23d10 nomor atomnya adalah 30.


















