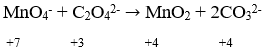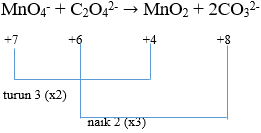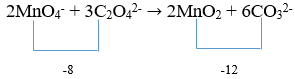Reasi redoks merupakan reaksi kimia yang melibatkan perubahan bilangan oksidasi. Reaksi ini pun merupakan reaksi gabungan dari reaksi reduksi dan reaksi oksidasi.
Untuk menyetarakan reaksi redoks tersebut dalam suasana basa terdapat 2 cara yaitu:
1. Metode Biloks
Pada metode ini terdapat beberapa langkah yaitu:
- Menentukan unsur yang mengalami perubahan bilangan oksidasi dan menyamakan jumlah atom yang mengalami perubahan bilangan oksidasi
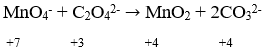
- Menentukan naik turun biloks
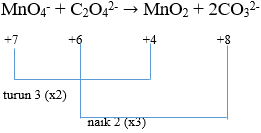
- Menyetarakan jumlah muatan dengan dengan menambahkan OH−
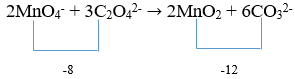
4OH−+2MnO4−+3C2O42−→2MnO2 + 6CO32−
- Menyerarakan jumlah H dengan menambahkan H2O secukupnya
4OH−+2MnO4−+3C2O42−→2MnO2 + 6CO32−+2H2O
2. Metode Setengah Reaksi
Metode setengah reaksi terdiri dari beberapa langkah yaitu:
- Menentukan reaksi reduksi dan reaksi oksidasi
Reduksi: MnO4−→MnO2
Oksidasi: C2O42−→CO32−
- Menyetarakan jumlah atom selain O dan H
Reduksi: MnO4−→MnO2
Oksidasi: C2O42−→2CO32−
- Menyetarakan jumlah atom O dan H
Menyetarakan atom O dengan menambahakan H2O pada ruas dengan jumlah O yang banyak.
Menyatarakan atom H dengan menambahkan OH−
Reduksi: MnO4− + 2H2O→MnO2 + 4OH−
Oksidasi: C2O42− + 4OH−→2CO32− + 2H2O
- Menyetarakan muatan dan dijumlahkan
Reduksi: MnO4− + 2H2O + 3e−→MnO2 + 4OH−
Oksidasi: C2O42− + 4OH−→2CO32− + 2H2O + 2e−
menjadi
Reduksi: 2MnO4− + 4H2O + 6e−→2MnO2 + 8OH−
Oksidasi: 3C2O42− + 12OH−→6CO32− + 6H2O + 6e−
2MnO4−+3C2O42−+4OH−→2MnO2+6CO32−+2H2O
Jadi, jawaban yang benar sesuai dengan uraian di atas.