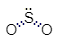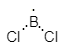Senyawa  dibentuk dari unsur S dan O. Konfigurasi elektron kedua unsur tersebut adalah:
dibentuk dari unsur S dan O. Konfigurasi elektron kedua unsur tersebut adalah:

Elektron valensi = 6

Elektron valensi = 6
Molekul yang dihasilkan dari satu atom S dan dua atom O dapat digambarkan dengan struktur lewis sebagai berikut.
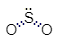
Pada molekul  terdapat dua ikatan kovalen rangkap dan satu pasang elektron bebas di atom pusat. Maka menurut teori domain elektron, bentuk molekulnya adalah
terdapat dua ikatan kovalen rangkap dan satu pasang elektron bebas di atom pusat. Maka menurut teori domain elektron, bentuk molekulnya adalah  yaitu bentuk bengkok.
yaitu bentuk bengkok.
Untuk senyawa  , konfigurasi elektron unsur B dan Cl adalah:
, konfigurasi elektron unsur B dan Cl adalah:

Elektron valensi = 3

Elektron valensi = 7
Molekul yang dihasilkan dari satu atom B dan dua atom Cl dapat digambarkan dengan struktur lewis sebagai berikut.
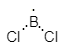
Pada molekul  terdapat dua ikatan kovalen tunggal. Tetapi, ada satu elektron tunggal yang tak berpasangan pada atom pusat B. Molekul dengan elektron tunggal yang tak berpasangan akan sangat reaktif dan tidak stabil. Maka, di alam tidak ada senyawa
terdapat dua ikatan kovalen tunggal. Tetapi, ada satu elektron tunggal yang tak berpasangan pada atom pusat B. Molekul dengan elektron tunggal yang tak berpasangan akan sangat reaktif dan tidak stabil. Maka, di alam tidak ada senyawa  .
.
Kemungkinan yang dimaksud oleh soal adalah senyawa  . Konfigurasi elektron unsur Be adalah:
. Konfigurasi elektron unsur Be adalah:

Elektron valensi = 2
Molekul yang dihasilkan dari satu atom Be dan dua atom Cl dapat digambarkan dengan struktur lewis sebagai berikut.

Pada molekul  terdapat dua ikatan kovalen tunggal dan tidak ada pasangan elektron tunggal lagi di atom pusat Be. Maka menurut teori domain elektron, bentuk molekulnya adalah
terdapat dua ikatan kovalen tunggal dan tidak ada pasangan elektron tunggal lagi di atom pusat Be. Maka menurut teori domain elektron, bentuk molekulnya adalah  yaitu bentuk linear.
yaitu bentuk linear.
Walaupun molekul  dan
dan  sama-sama memiliki dua pasang elektron ikatan, namun demikian pada molekul
sama-sama memiliki dua pasang elektron ikatan, namun demikian pada molekul  memiliki satu pasang elektron bebas. Adanya pasangan elektron bebas ini akan memberikan tolakan kepada dua pasang elektron ikatan, sehingga bentuk molekul
memiliki satu pasang elektron bebas. Adanya pasangan elektron bebas ini akan memberikan tolakan kepada dua pasang elektron ikatan, sehingga bentuk molekul  tidak bisa menjadi lurus atau linear seperti pada
tidak bisa menjadi lurus atau linear seperti pada  , melainkan berbentuk huruf V atau bengkok.
, melainkan berbentuk huruf V atau bengkok.
Jadi, bentuk molekul  dan
dan  berbeda karena pada
berbeda karena pada  terdapat pasangan elektron bebas sedangkan pada
terdapat pasangan elektron bebas sedangkan pada  tidak terdapat pasangan elektron bebas.
tidak terdapat pasangan elektron bebas.
dan
mempunyai bentuk yang berbeda. Mengapa bentuk molekul kedua senyawa tersebut berbeda? Jelaskan pendapatmu!