Dalam penentuan bentuk geometri molekul, diperlukan struktur lewis dari senyawa tersebut untuk menentukan jumlah PEI dan PEB. PEI adalah pasangan elektron yang digunakan untuk berikatan sedangkan PEB adalah pasangan elektron bebas yang tidak digunakan untuk berikatan. Rumus umum tipe molekul adalah AXE, dengan A adalah atom pusat X jumlah PEI dan E jumlah PEB.
Untuk mengetahui alasan molekul BeCl2 berbentuk linear, namun bentuk molekul H2O tetrahedral adalah dengan menentukan struktur lewis dari molekul-molekul tersebut.
Konfigurasi elektron Be, Cl, H dan O
4Be=2 2 (elektron valensi 2)
17Cl=2 8 7 (elektron valensi 7)
1H=1 (elektron valensi 1)
8O=2 6 (elektron valensi 6)
Struktur lewis BeCl2

Struktur lewis H2O
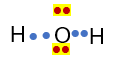
Pada struktur lewis BeCl2 terdapat 2 PEI (dot berwarna biru) dan tidak terdapat PEB, sehingga tipe molekulnya adalah AX2 dan bentuk molekulnya adalah linier. Sedangkan pada H2O terdapat 2 PEI (dot berwarna biru) dan 2 PEB (dot berwarna merah) sehingga tipe molekulnya adalah AX2E2 dan bentuk molekulnya adalah tetrahedral (planar bentuk V). Hal tersebutlah yang menyebabkan perbedaan bentuk molekul BeCl2 dan H2O.
Jadi, yang menyebabkan BeCl2 dan H2O memiliki bentuk molekul yang berbeda adalah BeCl2 memiliki 2 PEI dan tidak memiliki PEB, sehingga tipe molekulnya adalah AX2 dan bentuk molekulnya liniar. Sedangkan H2O memiliki 2 PEI dan 2 PEB sehingga tipe molekul AX2E2 dan bentuk molekulnya adalah tetrahedral.

















