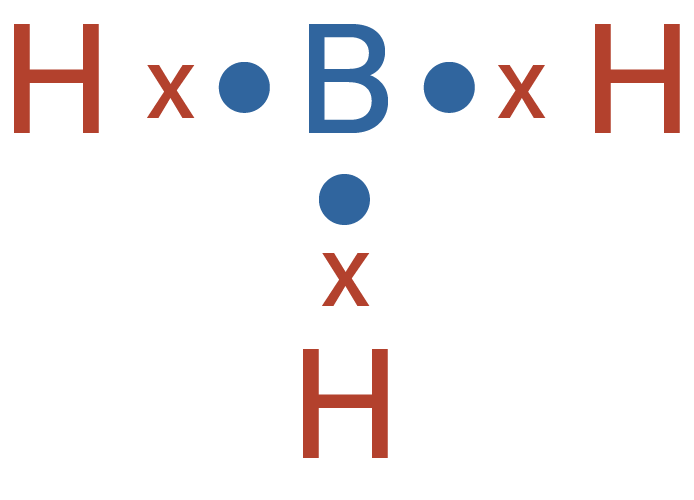Bentuk molekul (geometri molekul) adalah kedudukan atom-atom dalam molekul. Pada senyawa kovalen, ikatan kimia berupa sepasang elektron yang dipakai bersama sehingga bentuk molekul ditentukan oleh kedudukan pasangan elektron. Bentuk molekul dapat diramalkan dengan lambang atau struktur Lewisnya.
Menurut struktur Lewis, selain sepasang elektron yang digunakan untuk berikatan, juga digambarkan pasangan elektron yang tidak berikatan. Pasangan elektron yang tidak digunakan pada atom pusat untuk berikatan disebut pasangan elektron bebas (PEB). Untuk penyederhanaan, rumus molekul yang memiliki pasangan elektron bebas ditulis AXmEn, dengan A adalah atom pusat, X adalah pasangan elektron yang terikat pada atom pusat, dan E adalah pasangan elektron bebas.
Struktur Lewis senyawa BH3 dapat dibuat setelah mengetahui konfigurasi elektron kedua unsur tersebut.
5B1H==1s2 2s2 2p11s1
Berdasarkan konfigurasi elektronnya, dapat diketahui bahwa unsur B memiliki elektron valensi berjumlah 3, dan unsur H memiliki elektron valensi berjumlah 1. Pada senyawa BH3, unsur B berikatan dengan 3 buah atom H. Dengan demikian, maka setiap elektron valensi unsur B berikatan dengan elektron valensi atom H yang hanya memiliki 1 elektron. Struktur Lewis dari senyawa BH3 adalah sebagai berikut.
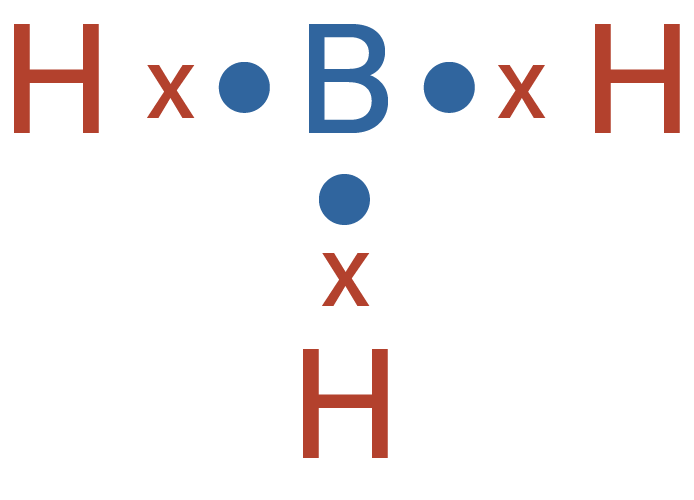
Berdasarkan struktur Lewis di atas, dapat diketahui bahwa pada atom pusat, yaitu B mempunyai 3 PEI dan tidak memiliki PEB. Dengan demikian tipe molekulnya adalah AX3 dan memiliki bentuk molekul segitiga planar.
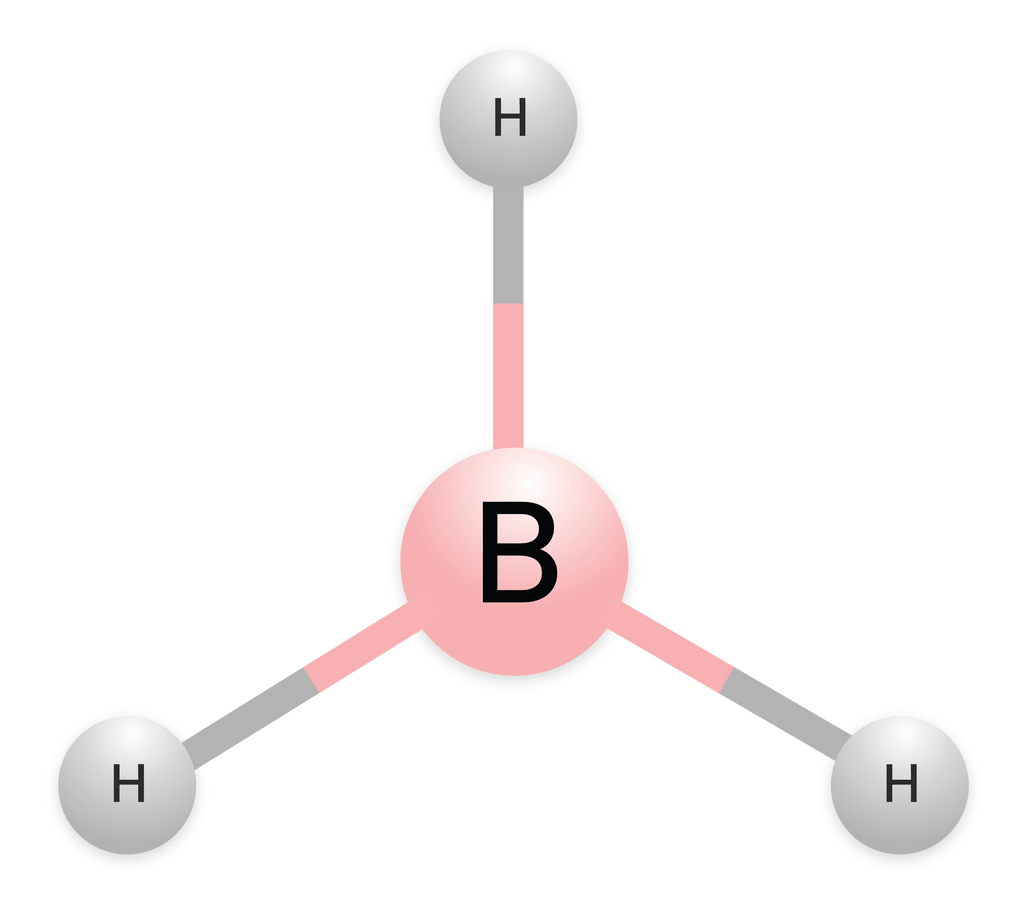
Jadi, jumlah PEI dalam senyawa BH3 adalah 3, dan jumlah PEB adalah 0, dan bentuk molekulnya adalah segitiga planar.