Molekul SOF4 mempunyai bentuk molekul trigonal bipiramida dan bersifat polar.
Struktur ruang atau bentuk suatu molekul dapat diramalkan berdasarkan adanya Pasangan Elektron lkatan (PEl) dan Pasangan Elektron Bebas (PEB) pada kulit terluar dari atom pusat di dalam molekul tersebut. Pasangan elektron yang terdapat pada kulit terluar dari suatu atom pusat memiliki muatan sejenis sehingga terjadi suatu gaya tolak-menolak. Pasangan-pasangan elektron ini akan memperkecil gaya tolak-menolak tersebut dengan membentuk suatu susunan tertentu. Teori ini dikenal sebagai Teori Tolakan Pasangan Elektron Kulit Valensi atau Teori VSEPR (Valence Shell Electron Pair Repulsion).
Dalam meramalkan geometri molekul berdasarkan teori VSEPR, kita perlu menentukan banyaknya PEI dan PEB pada atom pusat dengan rumus:

dengan:
A = atom pusat
X = pasangan elektron ikatan
m = jumlah PEI pada atom pusat
E = pasangan elektron bebas
n = jumlah PEB pada atom pusat
Sulfur (S) mempunyai konfigurasi elektron 16S : 2 8 6, oksigen (O) mempunyai konfigurasi elektron 8O : 2 6, dan fluor (F) mempunyai konfigurasi elektron 9F : 2 7. Molekul SOF4 memiliki struktur Lewis sebagai berikut:
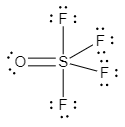
Rumus VSEPR dari SOF4 adalah AX5. Senyawa SOF4 memiliki bentuk molekul trigonal bipiramida.
Kepolaran suatu molekul dapat diprediksi melalui bentuk molekulnya. Senyawa dengan bentuk molekul simetris merupakan senyawa nonpolar, karena elektron tertarik sama kuat ke segala arah. Sementara senyawa dengan bentuk molekul asimetris merupakan senyawa polar, elektron tertarik ke salah satu atom menyebabkan adanya perbedaan keelektronegatifan.
SOF4 mempunyai bentuk molekul asimetris, elektron cenderung tertarik ke arah F yang lebih elektronegatif. Maka SOF4 merupakan senyawa polar.
















