Kepolaran merupakan terbentuknya kutub akibat adanya pasangan elektron yang lebih tertarik ke salah satu atom. Dalam suatu molekul, kepolaran tidak terjadi tidak hanya karena perbedaan keelektronegatifan atom-atom yang berikatan saja, melainkan juga karena bentuk molekulnya. Bentuk molekul menggambarkan kedudukan atom-atom pada suatu molekul dalam ruang tiga dimensi yang juga menunjukkan sudut-sudut ikatan yang terbentuk dalam suatu molekul.
Pada bentuk molekul simetris, seperti bentuk linier, segitiga planar, tetrahedral, dst., gaya tarik ikatan-ikatan tersebut adalah sama kuat dengan arah yang berlawanan, sehingga jika ikatan tersebut digambarkan sebagai vektor, resultan vektornya sama dengan 0 (momen dipol = 0). Hal ini menyebabkan tidak terbentuk kutub-kutub pada molekul tersebut (nonpolar).
Sebaliknya jika sudut ikatannya tidak sama besar, atau karena adanya pasangan elektron bebas, bentuk molekul tidak simetris dan arah ikatannya tidak berlawanan (resultan vektornya tidak sama dengan 0). Hal ini mengakibatkan terbentuk daerah yang lebih positif (kutub +) dan daerah yang lebih negatif (kutub -) pada molekul atau bersifat polar.
Contoh bentuk molekul yang bersifat polar adalah molekul air. Dua pasang elektron bebas terkumpul pada daerah atas sehingga terbentuk kutub negatif, sedangkan daerah berlawanan membentuk kutub positif. Ikatan O dengan H jika digambarkan sebagai vektor, tidak berada pada arah yang berlawanan sehingga resultan vektor atau momen dipolnya tidak sama dengan 0.
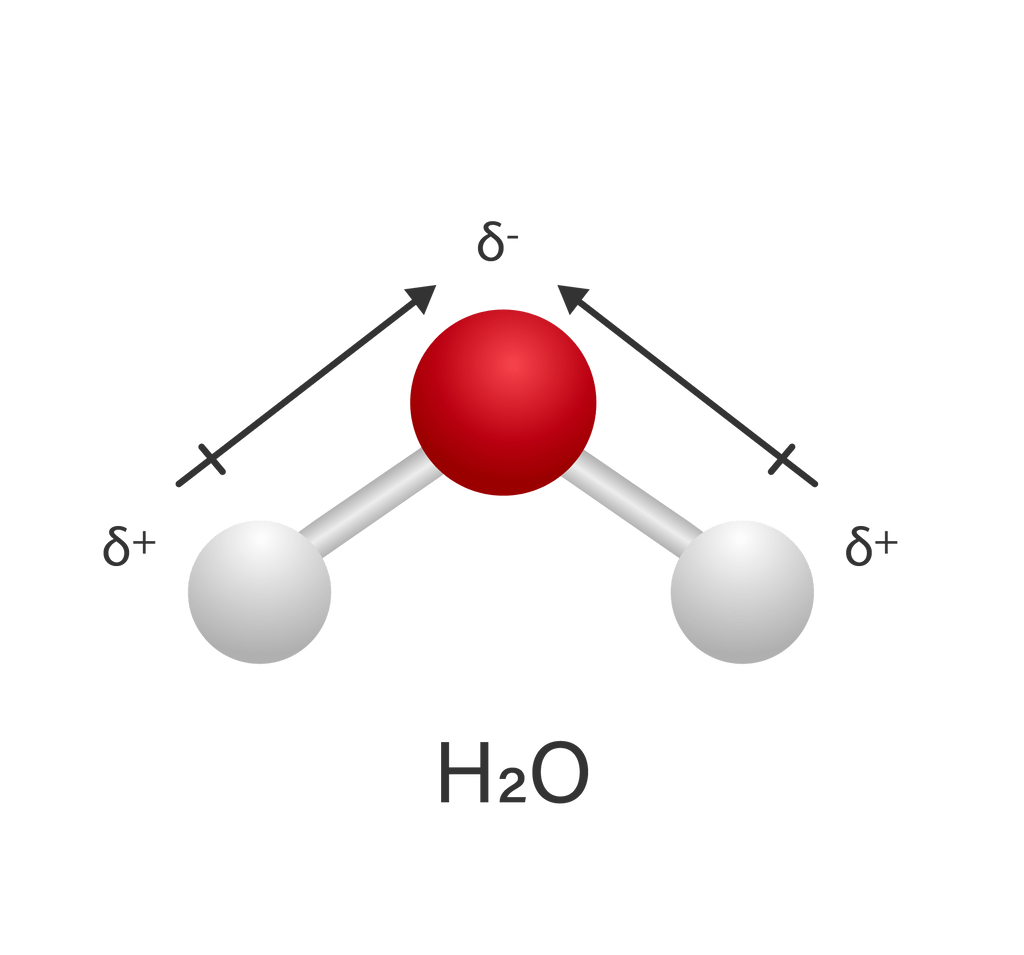
Bandingkan dengan molekul nonpolar berikut.
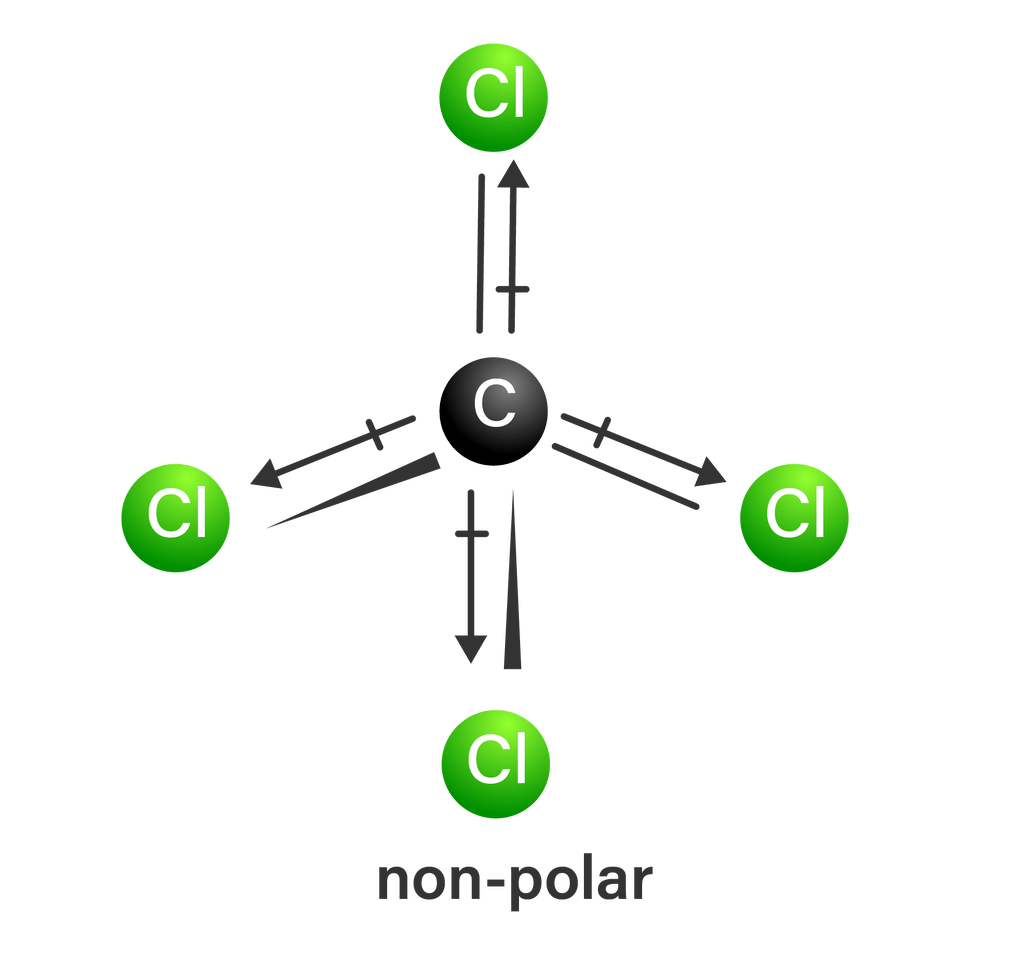
Pada molekul CCl4, 4 ikatan C dan Cl tertarik sama kuat dengan arah yang berlawanan, sehingga menghasilkan bentuk molekul yang simetris dan tidak terbentuk kutub (resultan vektornya = 0).
Jadi, kepolaran dipengaruhi oleh distribusi domain elektron pada molekul dan kesimetrisan bentuk molekul.

















