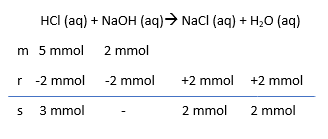Iklan
Pertanyaan
Sebanyak 50 mLlarutan HCI 0,1 M direaksikan dengan 20 mLlarutan NaOH 0,1 M. pH larutan tersebut adalah ....
Sebanyak 50 mL larutan HCI 0,1 M direaksikan dengan 20 mL larutan NaOH 0,1 M. pH larutan tersebut adalah ....
1,0
1,4
2,0
2,8
7,0
Iklan
AA
A. Acfreelance
Master Teacher
Jawaban terverifikasi
22
4.8 (6 rating)
AA
Abdullah Averouse Ibnu Sina
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia