Iklan
Pertanyaan
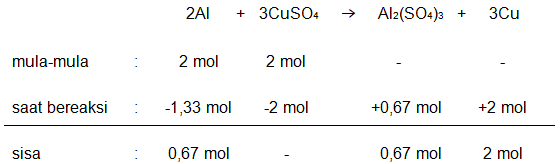
Sebanyak 5,4 gram Aluminium dilarutkan dalam 400 mL larutan tembaga (II) sulfat 0,5 M menurut persamaan reaksi berikut : Al + CuSO 4 → Al 2 ( SO 4 ) 3 + Cu Tentukan : a) Pereaksi pembatas b) Jumlah mol yang tersisa c) Jumlah massa yang terbentuk
Sebanyak 5,4 gram Aluminium dilarutkan dalam 400 mL larutan tembaga (II) sulfat 0,5 M menurut persamaan reaksi berikut :
Tentukan :
a) Pereaksi pembatas
b) Jumlah mol yang tersisa
c) Jumlah massa yang terbentuk
Iklan
SS
S. Susanti
Master Teacher
Mahasiswa/Alumni Universitas Jayabaya
Jawaban terverifikasi
9
4.3 (10 rating)
PI
Putu Indira
Pembahasan lengkap banget Makasih ❤️
DA
Dina Au_lia lalalaaa
Pembahasan lengkap banget
NA
Nur Aisyah Putri
Pembahasan tidak menjawab soal
DR
Danang Ramadhan
Ini yang aku cari!
AP
Andin Pramesty
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia