Iklan
Pertanyaan
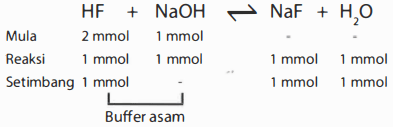
Sebanyak 20 ml larutan HF 0,1 M dititrasi dengan larutan NaOH 0,1 M, K a HF adalah 7 × 1 0 − 4 .Pernyataan yang benar untuk larutan hasil titrasi setelah penambahan 10 mL larutan NaOH adalah ...
Sebanyak 20 ml larutan HF 0,1 M dititrasi dengan larutan NaOH 0,1 M, HF adalah . Pernyataan yang benar untuk larutan hasil titrasi setelah penambahan 10 mL larutan NaOH adalah ...
Merupakan campuran asam lemah dan basa kuat
Merupakan campuran asam kuat dan basa lemah
Campuran asam lemah dan basa lemah
Memiliki pH > 7
Memiliki
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
25
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia