Iklan
Pertanyaan
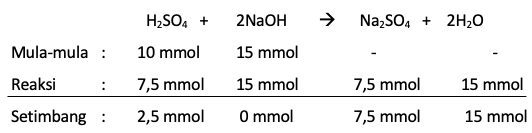
Sebanyak 150 mL larutan NaOH 0,1 M direaksikan dengan 100 mL larutan H 2 SO 4 0,1 M. a. Tuliskan persamaan reaksi setaranya. b. Tentukan pereaksi pembatasnya. c. Hitunglah pH larutan.
Sebanyak 150 mL larutan NaOH 0,1 M direaksikan dengan 100 mL larutan 0,1 M.
a. Tuliskan persamaan reaksi setaranya.
b. Tentukan pereaksi pembatasnya.
c. Hitunglah pH larutan.
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
4
5.0 (7 rating)
MG
Muhammad Guntur Rayasta
Pembahasan lengkap banget
NP
Nadia Prinitaloka
Pembahasan terpotong
I
Indira
Pembahasan lengkap banget
Hk
Heninur khasanah
Bantu banget
RB
RG BKL
Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia