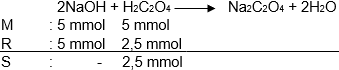Iklan
Pertanyaan
Sebanyak 100 ml larutan natrium hidroksida 0,05 M direaksikan dengan 100 ml asam oksalat 0,05 M menurut reaksi berikut. 2 NaOH ( a q ) + H 2 C 2 O 4 ( a q ) → Na 2 C 2 O 4 ( a q ) + 2 H 2 O ( l ) Pernyataan yang benar adalah . . .
Sebanyak 100 ml larutan natrium hidroksida 0,05 M direaksikan dengan 100 ml asam oksalat 0,05 M menurut reaksi berikut.
Pernyataan yang benar adalah . . .
Semua pereaksi habis bereaksi.
Reaksinya ekuivalen.
Reaksi tersebut tidak dapat berlangsung karena kedua reaktan saling melarutkan.
Terdapat sisa .
Terdapat sisa .
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
4.7 (8 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia