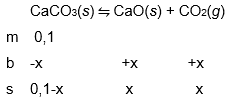Iklan
Pertanyaan
Reaksi penguraian kalsium karbonat memiliki tetapan kesetimbangan K p = 1,2 menurut reaksi: CaCO 3 ( s ) ⇌ CaO ( s ) + CO 2 ( g ) Jika 10 gram sampel CaCO 3 dimasukkan ke dalam wadah bervolume 4 liter dan dipanaskan hinggasuhu 90 0 ∘ C , berapa persen massa yangbereaksi hingga mencapai kesetimbangan? ( A r : Ca= 40 g mol − 1 , C = 12 g mol − 1 , dan R = 0,082)
Reaksi penguraian kalsium karbonat memiliki tetapan kesetimbangan = 1,2 menurut reaksi:
Jika 10 gram sampel dimasukkan ke dalam wadah bervolume 4 liter dan dipanaskan hingga suhu , berapa persen massa yang bereaksi hingga mencapai kesetimbangan? (: Ca = , C = , dan R = 0,082)
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
2
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia